网址:http://m.1010jiajiao.com/timu_id_57221[举报]
(6分).实验室中要除去细碎铜屑中的少量细碎铁屑,某同学设计了两个方案:
(1)Cu、Fe 过滤
过滤 洗涤
洗涤
(2)Cu、Fe 过滤
过滤 洗涤
洗涤
两个方案较好的是_______________(填序号),理由是______________________________。你是否有简便的方法,若有,请写出做法:__________________________________________。
查看习题详情和答案>>
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4 FeSO4+H2↑
FeSO4+H2↑
FeSO4+H2C2O4+2H2O FeC2O4·2H2O↓+H2SO4
FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
2Mn +5C2
+5C2 +16H+
+16H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。

(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40 ℃,理由是 ;得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤ (叙述此步操作),⑥计算。步骤③若未在干燥器中进行,测得的晶体中所含结晶水含量 (填“偏高”“偏低”或“无影响”);步骤⑤的目的是 。
(4)晶体中C2 含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
①下列操作及说法正确的是 。
A.滴定管用蒸馏水洗涤后,即可装入标准溶液
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体
C.接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
②有同学认为该滴定过程不需要指示剂,那么滴定终点的现象为 ,若达到滴定终点消耗高锰酸钾溶液V mL,那么晶体中所含C2 的质量分数为 (用含V、m的式子表示)。
的质量分数为 (用含V、m的式子表示)。
查看习题详情和答案>>
(6分).实验室中要除去细碎铜屑中的少量细碎铁屑,某同学设计了两个方案:
(1)Cu、Fe 过滤
过滤 洗涤
洗涤
(2)Cu、Fe 过滤
过滤 洗涤
洗涤
两个方案较好的是_______________(填序号),理由是______________________________。你是否有简便的方法,若有,请写出做法:__________________________________________。
(14分)FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用____(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;
②____________________。
(4) FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下:
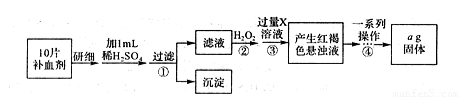
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大,’.“偏小”或“不变”)。
查看习题详情和答案>>
 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: