网址:http://m.1010jiajiao.com/timu_id_57193[举报]
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
____________________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程:

实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4•5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:

实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案制取胆矾:

(5)用试剂编号表示:试剂l为_____________,试剂2为_____________。
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?__________________________________
查看习题详情和答案>>
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为
。
,则混合物中Cu2O的质量分数为
。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
|
物 质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
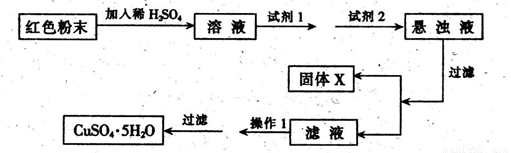
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。
查看习题详情和答案>>
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:_________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程:
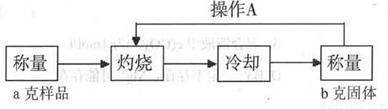
实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
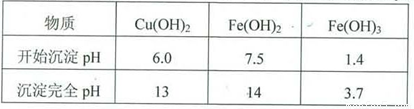
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案制取胆矾:
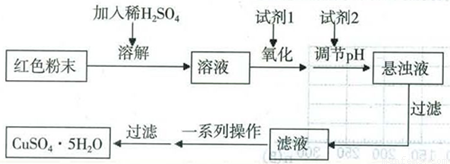
(5)用试剂编号表示:试剂l为_____________,试剂2为_____________。
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?
______________________________________________________________________________
查看习题详情和答案>>
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg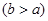 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
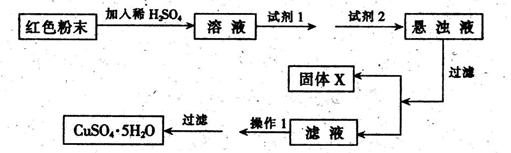
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。 查看习题详情和答案>>
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若只有Fe2O3,则实验现象是______.
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:______.
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物.实验小组欲测定Cu2O的质量分数.已知Cu2O在空气中加热生成CuO.
测定流程:
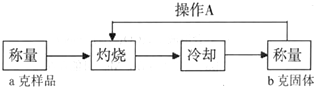
实验中操作A的名称为______.
灼烧过程中,所需仪器有:酒精灯、玻璃棒、______等(夹持仪器除外).
(4)写出混合物中Cu2O的质量分数的表达式______.
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案制取胆矾:
(5)用试剂编号表示:试剂l为______,试剂2为______.
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?______. 查看习题详情和答案>>