2008年泸州市高中二年级学期末统一考试化学试题
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,第I卷第1至4页,第II卷第5至8页。满分100分,90分钟完卷
第I卷(选择题 共50分)
注意事项:
1. 答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2. 每小题只有一个正确答案,答案选出后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。不能答在试题卷上。
3.供参考的相对原子质量:
H―1 N―14 O―16 Mg―24 Al―27 S―32 Fe―56 Cu―64 Zn―65
一、选择题(每小题只有一个选项符合题意。本题包括25小题,每小题2分,共50分)
1.下列各组物质中,互为同素异形体的是
A.
C.氯水和液氯 D.烧碱和火碱
2.下列物质中属于电解质的是
A.饱和食盐水 B.氯气 C.硫酸钡 D.酒精
3.下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2 N2O4
(正反应为放热反应)
N2O4
(正反应为放热反应)
B.3O2 2O3 (正反应为吸热反应)
2O3 (正反应为吸热反应)
C.H2(g) + I2(g) 2HI(g) (正反应为放热反应)
2HI(g) (正反应为放热反应)
D.NH4HCO3(S) NH3(g) + H2O(g)+CO2(g)
(正反应为吸热反应)
NH3(g) + H2O(g)+CO2(g)
(正反应为吸热反应)
4.对于可逆反应:N2 +3H2 2NH3(正反应为放热反应),下列说法中正确的是
2NH3(正反应为放热反应),下列说法中正确的是
A.反应达到平衡时,各物质的浓度不再发生变化
B.反应达到平衡时,各物质的浓度都相等
C.反应达到平衡时,各物质的浓度之比为1:2:3
D.降低温度时,反应的正反应速率增大,而逆反应速率减小
5.下列电离方程式中,正确的是
A.CH3COOH=CH3COO― + H+ B.H2SO3 2H+
+SO32―
2H+
+SO32―
C.HCO3-+H2O H3O+ +CO32-
D.Na2CO3
H3O+ +CO32-
D.Na2CO3 2Na+ + CO32―
2Na+ + CO32―
6.pH=2的盐酸和pH=2的硫酸等体积混合后,溶液的pH为
A.4
B.
7.下列反应式,表示盐类水解反应的是
A.HCO3― +OH―=H2O+CO32―
B.H2O +H2O H3O+ +OH―
H3O+ +OH―
C.S2―+H2O HS―+OH―
D.2Na+2H2O=2NaOH+H2↑
HS―+OH―
D.2Na+2H2O=2NaOH+H2↑
8.物质的量浓度相等的一元强酸与弱碱反应后,溶液的酸碱性为
A.呈酸性 B.呈碱性 C.呈中性 D.无法确定
9.用0.1mol/L盐酸溶液滴定未知浓度的NaOH溶液时,在滴定开始酸式滴定管中液体读数时用平视,而在滴定达到终点酸式滴定管中液体读数时,用仰视。则
待测液浓度会
A.偏大 B.偏小 C.没有影响 D.无法确定
10.下列各组物质中,在常温下能反应且有大量气体产生的是
A.铁与浓硫酸 B.铜与浓硝酸 C.铜与稀硫酸 D.铝与浓硝酸
11.在通常情况下能共存,且都可用浓硫酸干燥的气体组是
A.H2、H2S、SO2 B.NH3、CO2、HCl
C.N2、Cl2、CO2 D.NO、O2、CO
12.下列说法不正确的是
A. 白磷与红磷的相互转化是化学变化,但不是氧化还原反应
B. 少量的白磷应保存在水中
C. 氮元素的非金属性比磷元素强,而在通常情况下,磷单质却比N2活泼
D. 白磷分子(P4)的结构为正四面体,1mol白磷分子中含有4molP―P键
13.下列各组离子在溶液中,能大量共存的是
A.Na+、NH4+、H+、Cl― B.Al3+、K+、OH―、NO3―
C.Mg2+、H+ 、CO32―、SO42― D.Fe2+、H+、Cl―、NO3―
14.在一固定容积的密闭容器中,放入 2Q(g)+nR(g)。达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小1/3.则此反应中的n值为
2Q(g)+nR(g)。达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小1/3.则此反应中的n值为
A. 3
B.
15.在容积不变的密闭容器中进行如下反应:N2+3H2 2NH3,若将平衡系中各物质的浓度都增大到原来的2倍,则产生的结果是
2NH3,若将平衡系中各物质的浓度都增大到原来的2倍,则产生的结果是
A. 平衡向正反应方向移动 B.平衡不移动
C. 平衡向逆反应方向移动 D. 正反应速率增大,逆反应速率减小
16.在一定条件下,合成氨反应为:N2+3H2 2NH3,在
2NH3,在
A. v(H2)=0.015mol/(L?min) B. v(N2)=0.005mol/(L?min)
C. v(NH3)=0.0017mol/(L?min) D. v(NH3)=0.01mol/(L?min)
17. 以NA表示阿佛加德罗常数,则下列说法中正确的是
A.在标准状况下,
B.
C.
D.体积为
18.在常温下,1体积pH=2的盐酸与10体积某一元强碱溶液恰好完全中和,则该碱溶液的pH等于
19.只用一种试剂就能将NaCl、KSCN、AgNO3、NaOH 、Na2CO3 五种无色溶液一次性区别开来,这种试剂是
A. FeCl3溶液 B. BaCl2溶液
C. 稀H2SO4 D. Al2(SO4)3溶液
20.下列反应的离子方程式书写正确的是
A. 铝粉与氢氧化钾溶液 Al+2OH-=AlO2-+H2↑
B. 硫酸铝溶液里加入过量Ba(OH)2溶液 Al3++4OH-=AlO2-+2H2O
C. 氯化铁溶液与铁粉 Fe3++Fe=2Fe2+
D. 氢氧化铁与稀硫酸 Fe(OH)3+3H+=Fe3++3H2O
21.下列说法错误的是
A. 钢铁在潮湿的空气中发生电化学腐蚀的正极反应为:O2+4e-+2H2O=4OH-
B. 粗锌(含铁)与稀硫酸反应比纯锌快
C.铁粉中混有的铝粉可用NaOH溶液除去
D. 镁、铝、铁在常温下遇浓硫酸和硝酸都会发生钝化现象
22.现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中时,产生气泡都很慢,
而将C、D分别浸入稀硫酸中时,反应却很剧烈;把A、B用导线连接浸入稀硫酸
中时,A上有气泡产生;把C浸入D的硝酸盐溶液中时,C的表面却有D 析出。
则这四种金属的活泼性由强到弱的顺序为
A.A>B>C>D B.C>D>B>A
C.B>A>D>C D.D>C>B>A
23.在物质的量浓度均为0.1mol/L的①NH4Cl、②(NH4)2SO4、③NaHCO3、④NaOH四种溶液中,其PH由大到小的顺序为
A.④③①② B. ④③②① C. ①②③④ D. ④①③②
24.用物质的量均为0.1 mol的CH3COOH和CH3COONa配成
c(CH3COO-)>c(Na+),则下列对该混合溶液的判断正确的是
A. c(H+)<c(OH-)
B. c(CH3COO-)+c(CH3COOH)=0.2mol/L
C. c(CH3COOH)=c(CH3COO-)
D. c(CH3COO-)+c(OH-)=0.1mol/L
25.可逆反应:mA(s)+nB(g)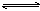 eC(g)+fD(g),在反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图所示。下列叙述正确的是
eC(g)+fD(g),在反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图所示。下列叙述正确的是
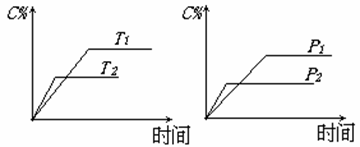
A.达到平衡后,若升高温度,平衡向逆反应方向移
B.达到平衡后,增加A的量有利于平衡向正反应方向移动
C.达到平衡后,加入催化剂则C%增大
D. 化学方程式中n>e+f
泸州市2008年高中二年级学期末统一考试
化 学 试 题
第II卷(非选择题 共50分)
注意事项:
1、用钢笔或圆珠笔直接答在试题卷上。
2、答题前将密封线内的项目填写清楚。
题号
二
三
四
总分
得分
二.填空题(本题包括6小题,共28分。)
26.(5分)氮气在通常情况下,化学性质比较稳定,但在条件改变时,也可以
跟很多物质发生化学反应。请按要求回答下列问题:
(1)氮分子的电子式为 ,通常情况下氮气化学性质比较稳定的原因是 。
(2)氮气在一定条件下与镁反应生成氮化镁(Mg3N2),氮化镁与水反应生成两种碱,其反应的化学方程为 。
27.(3分)在下列9种物质中:①氨气,②烧碱,③铜,④蔗糖,⑤食盐水,
⑥硝酸钾,⑦液溴,⑧冰醋酸,⑨氢氧化铝。填写下列空白(填序号):
(1)属于强电解质的有 ;
(2)属于非电解质的有 ;
(3)能导电但既不是电解质也不是非电解质的有 。
28.(4分)高锰酸钾和浓盐酸在常温下就能迅速反应制得氯气。其化学反应方程式可表示为:
KMnO4+ HCl(浓)= KCl+ MnCl2+ Cl2↑+ H2O
(1)配平上述化学反应方程式(将化学计量数填在化学式前面的横线上)
(2)在上述反应中,浓盐酸表现出还原性和酸性,则表现出还原性与表现出酸性的HCl物质的量之比为 。
(3)如果在反应中有1molCl2生成,则转移的电子的物质的量为 mol。
29.(4分)某温度下,在容积为 2SO3(g),1min达到平衡后测得有2 molSO2发生了反应,则:
2SO3(g),1min达到平衡后测得有2 molSO2发生了反应,则:
(1)1min内SO3的平均生成速率为 mol/(L?min);O2的转化率为 。
(2)达到平衡平衡后,在温度和容积不变的条件下,向容器中再充入1molHe,
则平衡将 (填序号)
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判
(3)若起始时,在上述容器中充入1mol SO2、0.5mol O2和3mol SO3(g),则达到平衡后,SO2的物质的量浓度为 mol/L。
30.(4分)将锌片和铜片用导线连接好,插入硫酸铜溶液中组成原电池。则在铜片上发生的电极反应式为
;若该电池中两个电极在反应前的总质量为
31.(8分)下列框图中涉及的物质都是中学化学中的常见物质。请根据框图中物质的变化,回答下列问题:
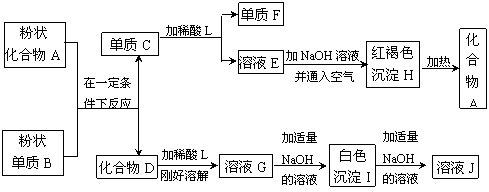
(1)写出下列物质的化学式:F是 ,J是 。
(2)稀酸L不可能是下列酸中的 。
A.H2SO4 B.HCl C.HNO3
(3)写出A+B→C+D的化学反应方程式(须注明反应条件):
。
(4)如何用化学方法检验溶液E中的金属阳离子?
。
三.简答题(共12分)
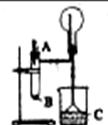
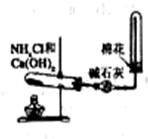
32.(12分)下图实验室制备氨气并进行氨气性质实验的装置。请完成:
 |
||||||||||
 |
||||||||||
 |
||||||||||
| ||||||||||
 26.(1) ∶N∶∶N∶(1分);氮气分子内的氮氮三键很牢固,故氮分子在通常情况下很稳定(2分)
26.(1) ∶N∶∶N∶(1分);氮气分子内的氮氮三键很牢固,故氮分子在通常情况下很稳定(2分)