2009年高考模拟考试
化学试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。第I卷1至4页,第II卷5至8页。满分100分,考试时间90分钟。
注意事项:
1 答卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型用2 B铅笔涂写在答题卡上。
2 I卷每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,yon个橡皮擦干净后,再选涂其它答案标号,不能答在试卷上。
3 考试结束,监考人员将答题卡和第II卷一并收回。
可能用到的相对原子质量:
H:
一、 选择题(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意)
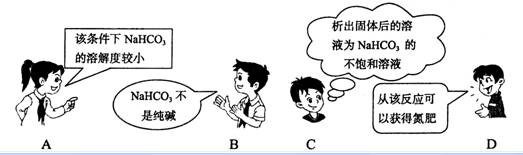
3 化学与生活密切相关,下列有关做法正确的是
A 为增加明矾净水效果,可同时加入氢氧化钡溶液
B 2009年春天为了缓解干旱,许多地方使用Agl或干冰人工降雨
C 为防止铁制品生锈,可在铁制品的外层涂油漆或局部镀铜
D 计算机硅芯片,光导纤维,普通玻璃都属于硅酸盐产品
4
A 4HNO3 4HNO2á +O2á+2H2O
4HNO2á +O2á+2H2O
B
2H2O2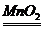 2H2O+O2á
2H2O+O2á
C 2Na2O2+2CO2====2Na2CO3+O2
D 2KClO3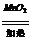 2KCl+3O2á
2KCl+3O2á
5 下列叙述正确的是
A 非金属氧化物一定不是碱性氧化物
B 氯水、水玻璃、水银、聚乙烯都是混合物
C 漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用物质分
D 电解质溶液的导电过程属于物理变化
6 下列有关颜色变化描述不正确的是
A 二氧化硫通入品红溶液à无色
B 淀粉溶液遇单质碘à蓝色
C 热的氧化铜遇乙醇à绿色
D 氯化铁溶液中滴加硫氰化钾à血红色
7 NA表示阿伏加德罗常数的值,下列有关NA的学术不正确的是
二、选择题(本题工包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
A 由Cu、Zn 和稀硫酸组成的原电池工作时,若Cu 极生成0.2gh2,则电路中通过的电子0.2 NA
B 在标准状况下,
C 1mol C4H10分子中共价键总数为13NA
D 标准状况下,
8 可能大量存在的离子组是
A 无色溶液中:H+ 、Na +、I-、ClO-
B 含有 HCO3-的溶液中:K+、Na+、SO32-、SO2-4
C 使pH试纸呈红色的溶液中:K+、Fe2+、NO-3、Cl-
D 由水电离的 的溶液中:
的溶液中: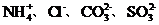
9 被称为万能还原剂的NaBH4(其中H元素为-1价)溶于水并和水反应:
NaBH4+2H2O====NaBO2+4H2á.下列说法正确的是
A NaBH4既是氧化剂又是还原剂
B NaBO2是氧化产物
C 硼元素被氧化,氢元素被还原
D 氧化产物与还原产物的质量比为1:1
10 用下列实验装置完成对应的实验,能达到目的的是
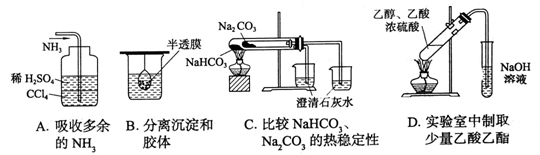
11 X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A X肯定是金属元素
B Y、Z两元素可形成共价化和物
C X 的原子序数肯定小于Y和Z
D 稳定性:Y的氢化物〉Z的氢化物
12 下列离子方程式书写正确的是
A 漂白粉溶液中通入 SO2气体 Ca2++2ClO-+SO2+H2O====CaSO3â+2HClO
B 往绿化铝溶液中加入过量的氨水Al3++4NH3?H2O====[Al(OH)4]-+4NH4+
C NaHS水解HS-+H2O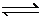 S2-+H3O+
S2-+H3O+
D 过量的NH4HSO4溶液与Ba(OH)2溶液反应
2H++SO2-4+Ba2++2OH-====BaSO4â+2H2
13 下列表述正确的是
A 任何能使熵值增大的过程都能自发进行
B 已知热化学方程式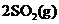 + O2(g)
+ O2(g)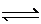 2SO3(g)
2SO3(g) 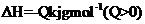 ,
,
则将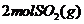 和1molO2(g)置于一密闭容器中充分反应后放出Q kJ 的热量
和1molO2(g)置于一密闭容器中充分反应后放出Q kJ 的热量
C 相同条件下C(s)+I/2O2(g)====GO(g)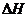
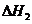 则
则
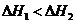
D 1molNaOH分别和1molCH2COOH、1molHHO3反应,后者必前者放出的热量多
14.经测定某种溶液中只含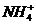 、
、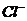 、
、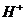 、
、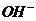 四种离子,下列说法不正确的是
四种离子,下列说法不正确的是
A. 四种离子之间不可能满足:
B. 若 ,则溶质一定是
,则溶质一定是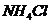 和
和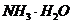
C. 若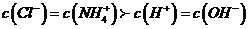 ,则溶液中溶质只有
,则溶液中溶质只有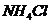
D, 若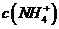
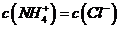 ,则溶液一定呈中性
,则溶液一定呈中性
15.一定温度下的难溶电解质 在水溶液中达到沉淀溶解平衡时,其平衡常数
在水溶液中达到沉淀溶解平衡时,其平衡常数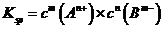 ,称为难溶电解质的离子积,在
,称为难溶电解质的离子积,在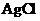 的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
物质
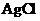
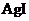
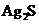
颜色
白
黄
黑
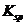 (
(
1.8×10-10
1.5×10-16
1.8×10-50
下列叙述不正确的是
A. 浓度积小的沉淀可以转化为溶度积更小的沉淀
B. 若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C. 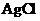 、
、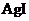 、
、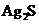 中所含
中所含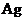 +的浓度相同
+的浓度相同
D. 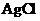 固体在等物质的量浓度的
固体在等物质的量浓度的 、
、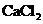 溶液中的溶度积相同
溶液中的溶度积相同
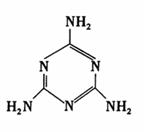 16.三聚氰胺的结构如右图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度
16.三聚氰胺的结构如右图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度
A, 是蛋白质
B, 是有机物,有弱碱性
C, 将购回的奶粉溶于热水后冷却,过滤,可以粗略检测其中是否含有三聚氰胺
D, 可以与盐酸反应
第II卷(非选择题 共58分)
必做题(17~21题)
三、(本题包括2小题,共18分)
17.(2分)下列试验操作或对试验事实的描述正确的是 (填序号)
①用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸
②向NaOH沸腾的溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③用饱和NaHCO3溶液除去CO2中混油的少量HCl
④用加热的方法提取NH4Cl固体中混有的少量碘
⑤仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末
⑥测溶液的pH:用玻璃棒蘸取溶液滴在湿润pH的试纸上,与标准比色卡对照
18.(16分) I 化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
乙组: 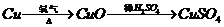 丙组:
丙组: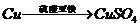
丁组:
戊组: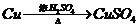
(1)甲组试验可用一个化学反应方程式表示为 ;
使反应变快的可能原因是
;从该反应器溶液(含有少量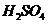 以抑制水解)中取得产品的试验操作步骤应为
、
、 ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的试验操作步骤应为
、
、 ,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是 组方案,有污染的是 组方案,无污染但能量消耗较高的是 组方案,因此选择 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜
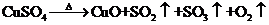 ,便决定设计试验测定反应生成的
,便决定设计试验测定反应生成的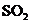 、
、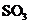 和
和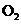 的物质的量,并经计算确定该条件下
的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:

试验测得数据及有关结果如下;
①准确称取 ;②在试验结束时干燥管总质量增加
;②在试验结束时干燥管总质量增加
按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是 。
(2)装置D的作用是 。
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
② ,
③ 。
(4)通过计算,推断出该条件下反应的化学方程式
四、(本题共12分)
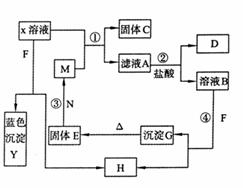 19.(12分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如右图(部分反应产物已略去)。
19.(12分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如右图(部分反应产物已略去)。
请回答下列问题;
(1) E的化学式为
(2) 将M丝插入盛有X溶液的试管中,反应一段时间后的现象是 。
(3) 在反应①②③④中属于置换反应的是 (填序号)
(4) 反应②的离子方程式为 。
(5) 用石墨作电极点解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;点解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出点解时的阳极反应式 。
②电解后溶液的pH为 (假设电解前后溶液体积不变)。
五、(本题包括2小题,共18分)
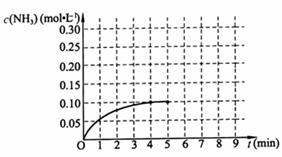 20.(10分)在一容积为
20.(10分)在一容积为
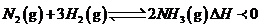 反应中NH3的物质的量浓度的变化情况如右图所示:请回答下列问题;
反应中NH3的物质的量浓度的变化情况如右图所示:请回答下列问题;
(1)根据上图,计算从反应开始到平衡时,平均反应速率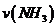 为
。
为
。
(2)该反应的化学平衡常数表达式K 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 。(填序号)。
a 0.20mol?L-1 b 0.12 mol?L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数
(填“增大”、“减少”或“不变”)。
(6) 在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
21.(8分)已知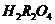 在水溶液中存在以上电离:
在水溶液中存在以上电离:
一级电离: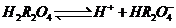 二级电离:
二级电离: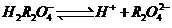
请回答一下问题:
(1)将0.1 mol?L-1的NaOH溶液与0.05 mol?L-1的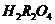 溶液等体积混合,冷却至室温测得溶液的pH
(填“等于
溶液等体积混合,冷却至室温测得溶液的pH
(填“等于
(2)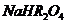 溶液
(填“呈酸性”、“呈碱性”或“无法确定”)。原因是
溶液
(填“呈酸性”、“呈碱性”或“无法确定”)。原因是
。
(3)某温度下,在0.1 mol?L-1的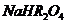 溶液中,以下关系一定不正确的是( )
溶液中,以下关系一定不正确的是( )
A 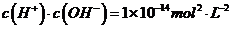
B Ph>1
C 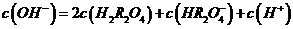
D 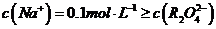
选做部分
六、(本题包括2个题,考生从中选择1个题作答)
【化学―物质结构与性质】
22.(10分)
(1)I 短周期某主族元素M的电离能情况如下图A所示。则M元素位于周期表的
第 族
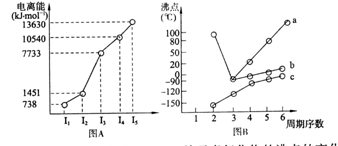
II 图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对ⅦA族元素氢化物的沸点地变化趋势画出了两条折线a和b,你认为正确的是 (填“a”或“b”)
(2)COCl2 俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有
(填序号):
A 2个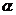 键
B 2个
键
B 2个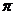 键 C 1个
键 C 1个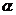 键、1个
键、1个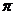 键
键
(3)金属钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,Ti元素基态原子的价电子排布式
[化学―有机化学基础]
23 (10分)试验室一试剂瓶的标签严重破损,只能隐约看到如下部分:
取该试剂瓶中的试剂,通过燃烧试验测得:0.1mol该物质完全燃烧指得到39.6gCO2和
(1) 通过计算可知该有机物的分子式为
(2) 进一步试验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体;②0.1mol该物质与足量金属钠反应可生成氢气2.24L(以折算成标准状况);③该物质在浓硫酸加热条件下生成含两个六元环的脂类;④该物质能发生消去反应。则该物质的结构简式为 。
(3) A经下列转化可以生成该物质,若取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液 ,出现白色沉淀。
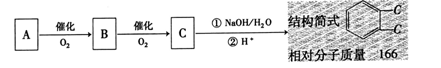
① 写出A转化成B的化学方程式:
;
其反应类型为
② 写出C发生水解反应的化学化学方程式:
。
2009年高考模拟考试
一、选择题(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意)
1.B 2.C 3.B 4.C 5.A 6.C
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
7.D 8.B 9.D 10.A 11.B 12.D 13.D 14.C 15.C 16.A
三、(本题包括2小题,共18分)
17.③⑤(共2分,每项1分,漏选一项扣1分,错选一项不得分)
18.(16分)
I(1) (2分);形成了原电池,加热蒸发、冷却结晶、过滤并洗涤晶体。
(2分);形成了原电池,加热蒸发、冷却结晶、过滤并洗涤晶体。
(2)丙,戊,乙,甲
Ⅱ(1)吸收 放出等物质的量的
放出等物质的量的
(2)干燥 和
和
(3)②调节量筒使其液面与E装置中的液面持平。
③读曲量筒中液体体积时,视线与液体的凹液面相平。(其他合理答案均可)
(4) (2分,期于每空1分)
(2分,期于每空1分)
四、(本题共12分,每空2分)
19.(12分)(1) (2分)
(2分)
(2)铁丝上附有红色物质,溶液颜色逐渐变为浅绿色。(2分)
(3)①③(2分)(每项1分,漏选一项扣1分,错选一项不得分)
(4) (2分)
(2分)
(5) (或
(或 (2分);1(2分)
(2分);1(2分)
五、(本题包括2小题,共18分)
 20.(10分)(1)
20.(10分)(1) (2分)
(2分)
(2) (2分)
(2分)
(3)a、c(2分,答对1个1分,多选、选错为0分)
(4)向正反应方向(1分);不变(1分)
(5)(2分)如右图:
21.(8分)(1)大于7(2分)
(2)无法确定,(1分) 溶液中同时存在
溶液中同时存在
 因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
(3)C、D(2分)
选做部分
六、(共2个题,考生从中选择1个题作答)
22.(10分)
(1)I.ⅡA(2分) Ⅱ.ⅣA(2分) b(2分)
(2) (1分) C(1分)
(1分) C(1分)
(3) (2分)
(2分)
23.(10分,每空2分)
(1) (2分)
(2分)
