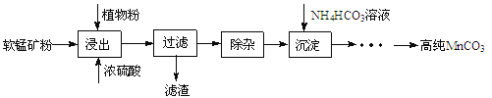
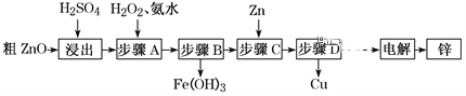
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,常将粗氧化锌粉碎成细颗粒,适当增加硫酸的浓度,目的是_________。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2 Zn(OH)2 ,该步骤需控制溶液pH的范围是____________,该步骤中先加入H2O2充分反应后再加入氨水,写出加入H2O2的离子方程式_____________。
(3)步骤C的反应离子方程式为____________。
(4)若步骤A中加入H2O2后,室温下将溶液的pH调为4,求Fe3+ 离子浓度为_________。(已知Ksp[Fe(OH)3]= 4.0×10-3 8)