题目内容
【题目】常温下,0.1mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法正确的是( )

A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2(H2C2O4)=4.17
C.0.1mol·L-1NaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
【答案】BC
【解析】
H2C2O4在水溶液中的电离平衡:H2C2O4![]() HC2O4-+H+,HC2O4-
HC2O4-+H+,HC2O4-![]() C2O42-+H+,pH减小(H+浓度增大),平衡逆向移动,pH增大(H+浓度减小),平衡正向移动,所以,pH最小时,溶液中的含碳粒子主要是H2C2O4,pH最大时,溶液中的含碳粒子主要是C2O42-,曲线①代表H2C2O4的含量,曲线③代表C2O42-的含量,曲线②代表HC2O4-的含量。
C2O42-+H+,pH减小(H+浓度增大),平衡逆向移动,pH增大(H+浓度减小),平衡正向移动,所以,pH最小时,溶液中的含碳粒子主要是H2C2O4,pH最大时,溶液中的含碳粒子主要是C2O42-,曲线①代表H2C2O4的含量,曲线③代表C2O42-的含量,曲线②代表HC2O4-的含量。
A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),A项错误;
B.Ka2(H2C2O4)=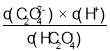 ,用曲线②与曲线③的交点数据计算,c(HC2O4-)=c(C2O42-),该点的pH=b=4.17,c(H+)=10-4.17,代入公式,得Ka2(H2C2O4)= c(H+)=10-4.17,pKa2(H2C2O4)=-lg(10-4.17)=4.17,B项正确;
,用曲线②与曲线③的交点数据计算,c(HC2O4-)=c(C2O42-),该点的pH=b=4.17,c(H+)=10-4.17,代入公式,得Ka2(H2C2O4)= c(H+)=10-4.17,pKa2(H2C2O4)=-lg(10-4.17)=4.17,B项正确;
C.0.1mol·L-1NaHC2O4溶液中,电荷守恒式:c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HC2O4-)①,物料守恒式:c(Na+)= c(H2C2O4) +c(HC2O4-)+c(C2O42-)②,①②联立,消掉c(Na+),得c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),C项正确;
D.CaC2O4饱和溶液中存在溶解平衡:CaC2O4(s)![]() Ca2+(aq)+C2O42-(aq),加入少量CaCl2固体,c(Ca2+)增大,平衡逆向移动,c(C2O42-)减小,根据勒夏特列原理,达到新的平衡时,c(Ca2+)仍比原平衡大,D项错误;
Ca2+(aq)+C2O42-(aq),加入少量CaCl2固体,c(Ca2+)增大,平衡逆向移动,c(C2O42-)减小,根据勒夏特列原理,达到新的平衡时,c(Ca2+)仍比原平衡大,D项错误;
答案选BC。

【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。