题目内容
【题目】Li—SOCl2电池是迄今具有最高能量比的电池。该电池的电极材料分别为锂和碳,电解液(熔点-110℃、沸点78.8℃)是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。下列说法正确的是( )
A.该电池不能在寒冷地区正常工作
B.SOCl2分子的空间构型是平面三角形
C.该电池工作时,正极反应为:2SOCl2+4e-=4Cl-+S+SO2
D.该电池组装时,必须在无水无氧条件下进行
【答案】CD
【解析】
根据电池的总反应可知,失电子的是Li,在负极发生反应,得电子的是SOCl2,在正极发生反应;电解液的熔点为-110℃、沸点为78.8℃,电池可以在-110℃~78.8℃温度范围内正常工作。
A.该电池可以在-110℃~78.8℃环境下正常工作,A项错误;
B.SOCl2分子的中心原子为S,其价层电子对数=3+![]() (6-1×2-2×1)=4,VSEPR模型为四面体形,中心原子上的孤电子对数=
(6-1×2-2×1)=4,VSEPR模型为四面体形,中心原子上的孤电子对数=![]() (6-1×2-2×1)=1,则SOCl2分子的立体构型为三角锥形,B项错误;
(6-1×2-2×1)=1,则SOCl2分子的立体构型为三角锥形,B项错误;![]()
C.根据电池的总反应方程式,可知正极反应为:2SOCl2+4e-=4Cl-+S+SO2,C项正确;
D.Li是活泼金属,易与O2反应,也能与水反应,SOCl2遇水会发生反应:SOCl2+H2O=SO2+2HCl,因此该电池组装时,必须在无水无氧条件下进行,D项正确;
答案选CD。
中心原子的价层电子对数 | 2 | 3 | 4 |
VSEPR模型 | 直线形 | 平面三角形 | 四面体 |

【题目】下表为部分一氯代烷的结构简式和沸点数据,下列对表中物质与数据的分析归纳,错误的是( )
物质代号 | 结构简式 | 沸点/℃ |
① |
|
|
② |
| 12.3 |
③ |
| 46.6 |
④ |
| 35.7 |
⑤ |
| 78.44 |
⑥ |
| 68.2 |
⑦ |
| 52 |
A.物质①②③⑤互为同系物
B.一氯代烷同分异构体的沸点随着支链的增多而升高
C.一氯代烷的沸点随着碳原子数的增多而升高
D.物质⑤与⑦互为同分异构体
【题目】汽车尾气中的CO和NO在排放时会发生复杂的化学反应。回答下列问题:
(1)通过NO传感器可监测汽车排放尾气中NO含量, 其工作原理如图所示。

该传感器正极的电极反应式为 _________________。
(2)已知如下发生反应:
①2CO(g)+O2(g)=2CO2(g) △H1 =-606.6 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2= -114.1 kJ·mo l-1
则反应CO(g) +NO2(g) = CO2(g) +NO(g)的△H =__________kJmo l-1
(3)300K时,将等浓度的CO 和 NO2混合加入刚性密闭容器中,发生反应CO(g) +NO2(g) = CO2(g) +NO(g), 测得 c(CO)浓度随时间t 的变化如表所示。
t/min | 0 | 20 | 90 | 170 | 560 | 1600 | 13200 | 14000 | ∞ |
c(CO)/mol·L-1 | 0.100 | 0.075 | 0.055 | 0.047 | 0.034 | 0.025 | 0.013 | 0.013 | 0.013 |
①300K时反应的平衡转化率α=_______%。平衡常数K=_______(保留1 位小数)。
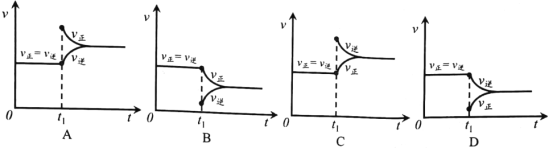
②在300K下: 要提高CO转化率, 可采取的措施是_____________;要缩短反应达到平衡的时间,可采取的措施有______________、____________________。
③实验测得:反应物浓度按任意比时,该反应的正反应速率均符合v正=k正c2(NO2)。其中:k正为正反应速率常数,是与平衡常数K类似的只受温度影响的常数。请推理出v逆的表达式:v逆=_____________ (用k正 、 K 与c(CO)、c(CO2 )、c(NO)表达)。
④根据v逆的表达式 ,一定温度下,当反应达平衡后, t1时刻增大CO浓度, 平衡发生移动,下列图像正确的是______________。