题目内容
【题目】向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)![]() 3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
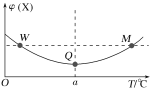
A.M点时,Y的转化率最大
B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小
D.W、M两点Y的正反应速率相同
【答案】C
【解析】
起始时向容器中充入2molX(g)和1molY(g),反应从左到右进行,结合图像,由起点至Q点,X的体积分数减小;Q点之后,随着温度升高,X的体积分数增大,意味着Q点时反应达到平衡状态,温度升高,平衡逆向移动,反应从右向左进行。
A.Q点之前,反应向右进行,Y的转化率不断增大;Q点→M点的过程中,平衡逆向移动,Y的转化率下降,因此Q点时Y的转化率最大,A项错误;
B.平衡后充入X,X的体积分数增大,平衡正向移动,根据勒夏特列原理,平衡移动只能减弱而不能抵消这个改变,达到新的平衡时,X的体积分数仍比原平衡大,B项错误;
C.根据以上分析,升高温度,平衡逆向移动,平衡常数减小,C项正确;
D.容器体积不变,W、M两点,X的体积分数相同,Y的体积分数及浓度也相同,但M点温度更高,Y的正反应速率更快,D项错误;
答案选C。

 期末1卷素质教育评估卷系列答案
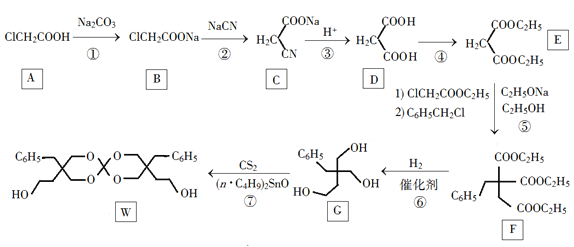
期末1卷素质教育评估卷系列答案【题目】钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子排布图为__。
(2)已知电离能:I2(Ti)=1310kJ·mol-1,I2(K)=3051kJ·mol-1。I2(Ti)<I2(K),其原因为__。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
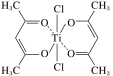
①钛的配位数为__,碳原子的杂化类型__。
②该配合物中存在的化学键有__(填字母)。
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)钛与卤素形成的化合物熔、沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是__。
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_。阴离子的立体构型为__。
![]()
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg·cm-3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为___pm。(用含ρ、NA的代数式表示)
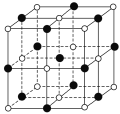
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
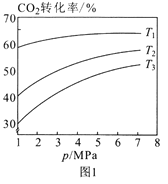
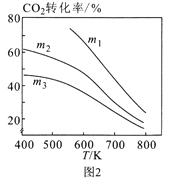
①图1中投料比相同,温度从高到低的顺序为____。
②图2中m1、m2、m3从大到小的顺序为____。
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
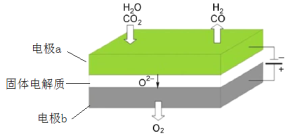
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。