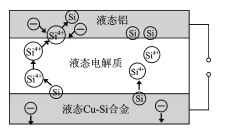
题目内容
【题目】下列有关电化学原理的说法正确的是
A.用惰性电极电解MgCl2饱和溶液可制得金属镁
B.用惰性电极电解CuCl2溶液时,阳极表面生成红色物质
C.在铁钉表面电镀铜时,将铁钉作阳极,铜作阴极,硫酸铜溶液为电解质
D.用石墨电极电解饱和食盐水的过程中,溶液的pH逐渐增大
【答案】D
【解析】
A.Mg是比较活泼的金属,用惰性电极电解MgCl2饱和溶液,溶液中水电离出的H+在阴极的放电性比Mg2+强,故用惰性电极电解MgCl2饱和溶液不能制得金属镁,A错误;
B.用惰性电极电解CuCl2溶液时,阳极发生氧化反应,阳极反应式为2Cl--2e-=Cl2↑,阳极表面无红色物质生成,B错误;
C.在电镀时,镀件作阴极,镀层金属作阳极,含镀层金属阳离子的盐溶液作电解质溶液,在铁钉表面电镀铜时,将铁钉作阴极,铜作阳极,硫酸铜溶液为电解质溶液,C错误;
D.用石墨电极电解饱和食盐水的电解方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,故用石墨电极电解饱和食盐水的过程中,溶液的pH逐渐增大,D正确;
2NaOH+H2↑+Cl2↑,故用石墨电极电解饱和食盐水的过程中,溶液的pH逐渐增大,D正确;
答案选D。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
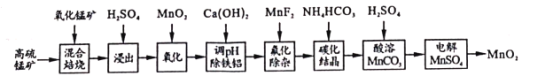
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)写出浸出时与铝元素有关的离子反应方程式____。
(2)上述“氧化”步骤是否可省略____(填“是”或“否”),你的依据是 _____。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为____;“氟化除杂”中除去的离子为____。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程___(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为____;整个流程中能够循环利用的物质除MnO2外还有___(写名称)。