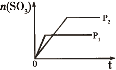
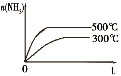
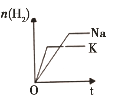
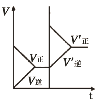
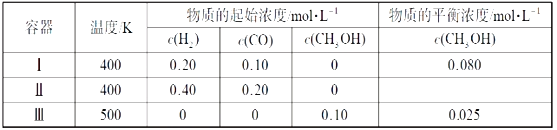
【题目】下列研究目的和示意图相符的是( )
选项 | A | B | C | D |
研究目的 | 密闭容器中,压强对反应:2SO2(g)+O2(g) | 固定容积的密闭容器中,温度对反应:N2(g)+3H2(g) | 等质量Na、K分别与足量水反应 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g) |
示意图 |
|
|
|
|
A.AB.BC.CD.D
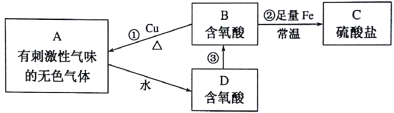
【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
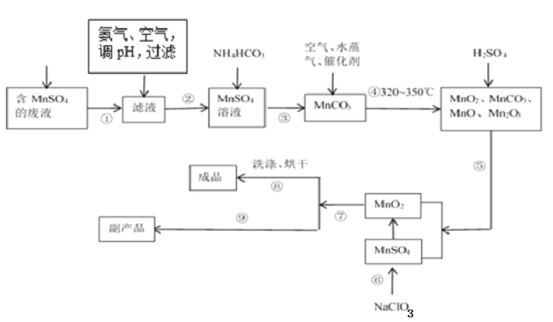
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
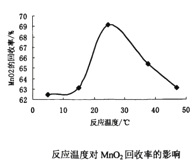
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请按要求回答下列问题:
(1)元素①与⑨组成的化合物的电子式:_______;元素②的原子结构示意图_______。
(2)对比相同条件下元素⑥、⑦的单质分别与水反应的剧烈程度,可得到的结论:同一周期元素,随核电荷数的增加,_______;写出元素⑥的单质与水反应的化学方程式_______。
(3)能说明元素⑤的非金属性强于元素⑨的依据是_______。
(4)元素①与②所形成的最简单有机物的结构式是_______。元素①与②所形成的最简单烯烃为M,写出M与元素①的单质在一定条件下反应的化学方程式:_______,该反应类型为_______。