题目内容
【题目】常见含硫物质A~D,在生活、生产中有着广泛应用,它们之间的转化关系如下图所示。其中反应①、②中所需物质B溶液的浓度不同。
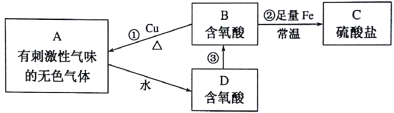
请按要求回答下列问题:
(1)A的化学式为_______。
(2)反应①、②中Cu、Fe所起的作用相同,即都作_______(填“氧化剂”或“还原剂”),你判断的依据是它们都是金属,在反应中都_______。
(3)反应②的离子方程式为_______。
(4)大气中因废气A引起酸雨的反应流程之一可用下图示意:
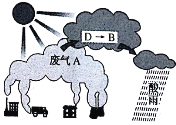
上图中由D→B的转化所需氧化剂为_______。
当将含D的雨水敞口放置一段时间后(忽略溶液体积、温度的变化),其c(H+)将_______。(填“增大”“减小”或“不变”)。废气A是一种重要的化工原料,常采用氨吸收法进行循环利用、变废为宝。某工厂若将4.48×106L(标准状况下)废气A进行环保处理,完全转化为 NH4HSO3时,需消耗10mol/L氨水溶液(溶质全部以NH3H2O计)的体积为_______L。
【答案】SO2 还原剂 失去电子,化合价升高 Fe+2H+=Fe2++H2↑ O2 增大 2000
【解析】
由B(含氧酸)在常温下与足量的铁反应生成C(硫酸盐),故B是H2SO4,反应方程式为Fe+2H2SO4=FeSO4+H2↑,C是FeSO4;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故A是SO2,SO2+H2O
CuSO4+SO2↑+2H2O,故A是SO2,SO2+H2O ![]() H2SO3,D是H2SO3。
H2SO3,D是H2SO3。
(1)由解析可知,A的化学式为SO2;
(2)反应①、②中,反应前后Cu、Fe元素的化合价都升高,故反应①、②中Cu、Fe所起的作用相同,即都作还原剂;
(3)铁与稀硫酸常温下反应,离子方程式为Fe+2H+=Fe2++H2↑;
(4)H2SO3→H2SO4过程中,S元素化合价升高,即H2SO3被空气中的O2氧化为H2SO4;2H2SO3+ O2= H2SO4,H2SO3是弱酸,H2SO4是强酸,故当将含H2SO3的雨水敞口放置一段时间后(忽略溶液体积、温度的变化),其c(H+)将增大;SO2+NH3H2O=NH4HSO3,n(SO2)= ![]() =2.0×105mol,故n(NH3H2O)= 2.0×105mol,需消耗10mol/L氨水溶液(溶质全部以NH3H2O计)的体积为
=2.0×105mol,故n(NH3H2O)= 2.0×105mol,需消耗10mol/L氨水溶液(溶质全部以NH3H2O计)的体积为![]() =2000L。
=2000L。

 阅读快车系列答案
阅读快车系列答案