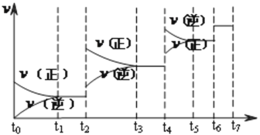
【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。
【题目】I.(1)写出H2CO3的电离方程式:__________________________________________。
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①﹦②
①当它们物质的量浓度相等时,中和等体积、等物质的量浓度的烧碱溶液需两种酸溶液的体积关系为____________。
②当它们氢离子浓度相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为____________。
II.煤化工产业中常用合成气(主要成分是氢气和一氧化碳气体)合成氨和甲醇。请回答:
(1)工业合成氨的化学方程式为N2+3H2![]() 2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________。
2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________。
(2)合成甲醇的主要反应是2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
物质 | H2 | CO | CH3OH |
浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________。
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡______(填“逆向”、“正向”或“不”)移动,平衡常数K_________(填“增大”、“减小”或“不变”)。
【题目】(1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧的热化学方程式: ____________________。
(2)合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
2NH3(g)ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
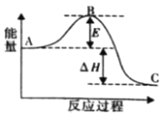
①该反应通常用铁作催化剂,加催化剂会使图中E______(填“变大”或“变小”),E的大小对该反应的反应热有无影响?______(填“有”或“无”)。
②有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a为____________。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①N2(g)+2O2(g)=2NO2(g) △Η1=a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △Η2=bkJ/mol
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:_____________________。
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80℃达到平衡时,测得![]() ,则Ni(CO)4的平衡浓度为2mol/L
,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时反应向正向进行。