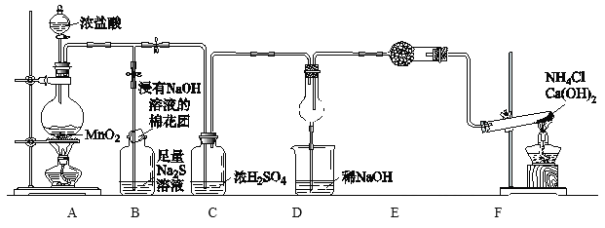
题目内容
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80℃达到平衡时,测得![]() ,则Ni(CO)4的平衡浓度为2mol/L
,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时反应向正向进行。
【答案】D
【解析】
分析表中所给数据可知,随着温度身高,平衡常数逐渐变小,可知正反应为放热反应。根据反应方程式:Ni(s) + 4CO(g) ![]() Ni(CO)4(g),可知其平衡常数
Ni(CO)4(g),可知其平衡常数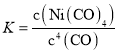 。进而求解。
。进而求解。
A.温度升高,平衡常数减小,则上述生成Ni(CO)4(g)的反应为放热反应,A项正确;
B.由题所给数据可知,25℃时Ni(s) + 4CO(g) ![]() Ni(CO)4(g)的平衡常数
Ni(CO)4(g)的平衡常数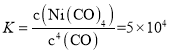 ,25℃时,反应Ni(CO)4(g)
,25℃时,反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数
Ni(s)+4CO(g)的平衡常数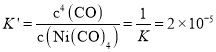 ,B项正确;
,B项正确;
C.80℃达到平衡时,![]() ,可得
,可得![]() ,此时
,此时 ,可知
,可知![]() ,C项正确。
,C项正确。
D.在80℃时,此时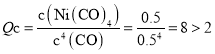 ,即
,即![]() ,反应向逆反应方向进行,D项错误;
,反应向逆反应方向进行,D项错误;
答案选D。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。