ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩI.Ρ≥Έ¬Ε» ±Θ§‘Ύ“ΜΗω2LΒΡΟή±’»ίΤς÷–Θ§XΓΔYΓΔZ»ΐ÷÷ΤχΧ§Έο÷ ΒΡΈο÷ ΒΡΝΩΥφ ±ΦδΒΡ±δΜ·«ζœΏ»γΆΦΥυ ΨΓΘΗυΨίΆΦ÷– ΐΨίΘ§ ‘Χν–¥œ¬Ν–Ω’ΑΉΘΚ

ΔΌΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____________________________ΓΘ
ΔΎ¥”ΩΣ Φ÷Ν2minΘ§ZΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ________________ΓΘ
Δέ»τ“ΣΧαΗΏXΒΡΉΣΜ·¬ Θ§«κΧα≥ωΝΫΧθΚœάμ¥κ ©_______________________________ΓΔ____________________________ΓΘ
II.Ρ≥ΧΫΨΩ–‘―ßœΑ–ΓΉι”ΟœύΆ§÷ ΝΩΒΡ–ΩΚΆœύΆ§≈®Ε»ΒΡΉψΝΩΒΡœΓ―ΈΥαΖ¥”ΠΒΟΒΫ Β―ι ΐΨί»γ±μΥυ ΨΘΚ
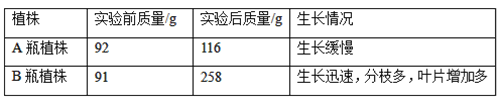
Β―ι±ύΚ≈ | –ΩΒΡΉ¥Χ§ | Ζ¥”ΠΈ¬Ε»/Γφ | ’Φ·100mL«βΤχ Υυ–η ±Φδ/s |
Δώ | ±ΓΤ§ | 15 | 200 |
Δρ | ±ΓΤ§ | 25 | 90 |
Δσ | ΖέΡ© | 25 | 10 |
ΔΌΗΟ Β―ιΒΡΡΩΒΡ «ΧΫΨΩ__________ΓΔ__________Ε‘–ΩΚΆœΓ―ΈΥαΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘΜ
ΔΎ Β―ιΔώΚΆΔρ±μΟς__________Θ§Μ·―ßΖ¥”ΠΥΌ¬ ‘Ϋ¥σΘΜ
ΔέΡή±μΟςΙΧΧεΒΡ±μΟφΜΐΕ‘Ζ¥”ΠΥΌ¬ ”–”ΑœλΒΡ Β―ι±ύΚ≈ « ______ ΚΆ ______ ΓΘ
ΓΨ¥πΑΗΓΩ3X+Y ![]() 2Z 0.05 molL-1min-1 ‘ω¥σYΒΡ≈®Ε» Φ”―ΙΘ§ΦΑ ±ΫΪZ¥”ΧεœΒ÷–Ζ÷άκ≥ω»ΞΒ»»Έ“βΝΫΧθ Ζ¥”ΠΈοΫ”¥ΞΟφΜΐ Ζ¥”ΠΈ¬Ε» Ζ¥”ΠΈ¬Ε»‘ΫΗΏ II III
2Z 0.05 molL-1min-1 ‘ω¥σYΒΡ≈®Ε» Φ”―ΙΘ§ΦΑ ±ΫΪZ¥”ΧεœΒ÷–Ζ÷άκ≥ω»ΞΒ»»Έ“βΝΫΧθ Ζ¥”ΠΈοΫ”¥ΞΟφΜΐ Ζ¥”ΠΈ¬Ε» Ζ¥”ΠΈ¬Ε»‘ΫΗΏ II III
ΓΨΫβΈωΓΩ
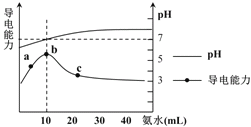
Ζ÷ΈωΧβΗχ–≈œΔΘ§Ω…“‘Ω¥≥ωΘ§‘Ύn-tΆΦ÷–Θ§ΥφΉ≈ ±ΦδΒΡΫχ––Θ§XΓΔYΒΡΈο÷ ΒΡΝΩΖ÷±π¥”1.0÷πΫΞΦθ–ΓΒΫ0.7ΓΔ0.9Θ§»ΜΚσ≤Μ‘ΌΖΔ…ζΗΡ±δΘ§ZΒΡΈο÷ ΒΡΝΩ¥”0÷πΫΞ‘ω¥σΒΫ0.2Θ§»ΜΚσ±Θ≥÷≤Μ±δΘ§Ω…“‘ΒΟ≥ωXΓΔYΈΣΖ¥”ΠΈοΘ§ZΈΣ…ζ≥…ΈοΘ§ΗυΨίΗςΈο÷ ΒΡΈο÷ ΒΡΝΩΒΡ±δΜ·÷ΒΘ§Ω…“‘ΒΟ≥ω’ΐ»ΖΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΘ§ΫχΕχΫχ––œύΙΊΦΤΥψΓΘ
IΘ°ΔΌ”…ΆΦΩ…÷ΣΘ§![]() Θ§
Θ§![]() Θ§
Θ§![]() Θ§ΤδΜ·―ßΦΤΝΩ ΐ÷°±»Β»”ΎΤδΈο÷ ΒΡΝΩΒΡΉΣΜ·ΝΩ÷°±»Θ§Ω…ΒΟ≥ωΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΈΣΘΚ3X+Y
Θ§ΤδΜ·―ßΦΤΝΩ ΐ÷°±»Β»”ΎΤδΈο÷ ΒΡΝΩΒΡΉΣΜ·ΝΩ÷°±»Θ§Ω…ΒΟ≥ωΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΈΣΘΚ3X+Y ![]() 2ZΘΜ
2ZΘΜ
ΔΎ¥”ΩΣ Φ÷Ν2minΘ§ZΒΡΤΫΨυΖ¥”ΠΥΌ¬  ΘΜ
ΘΜ
Δέ“ΣΧαΗΏXΒΡ≤ζ¬ Θ§Ω…“‘≤…»ΓΦ”―ΙΓΔ‘ω¥σYΒΡ≈®Ε»ΓΔΦΑ ±ΫΪZ¥”ΧεœΒ÷–Ζ÷άκ≥ω»ΞΒ»ΖΫΖ®ΘΜ
IIΘ°ΔΌ”…ΧβΗχΆΦ±μ ΐΨίΩ…“‘Ω¥≥ωΘ§”–ΝΫΗω±δΝΩΘΚ“ΜΗω «–ΩΒΡΉ¥Χ§Θ§“ΜΗω «Ζ¥”ΠΈ¬Ε»Θ§‘ρ Β―ιΡΩΒΡ «ΧΫΨΩΖ¥”ΠΈοΫ”¥ΞΟφΜΐΓΔΖ¥”ΠΈ¬Ε»Ε‘–ΩΚΆœΓ―ΈΥαΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘΜ
ΔΎ–ΩΉ¥Χ§œύΆ§ΧθΦΰœ¬Θ§Έ¬Ε»‘ΫΗΏ ’Φ·ΒΫΒ»ΝΩ«βΤχΒΡ ±Φδ‘ΫΕΧΘ§ΥΒΟςΈ¬Ε»‘ΫΗΏΘ§Ζ¥”ΠΥΌ¬ ‘ΫΩλΘΜ
ΔέIIΚΆΔσ≥ΐΝΥ–ΩΒΡΉ¥Χ§≤Μ“Μ―υΘ§Ζ¥”ΠΈ¬Ε»“Μ―υΘ§‘ρ’βΝΫΉι ‘―ι±μΟςΝΥΈο÷ ΒΡ±μΟφΜΐΕ‘Ζ¥”ΠΥΌ¬ ”–”ΑœλΓΘ