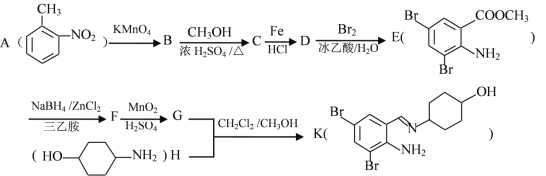
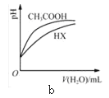
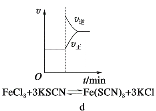
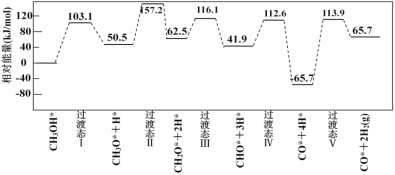
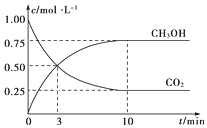
【题目】对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A.AB.BC.CD.D
【题目】氮的化合物在相互转化、工业生产等方面应用广泛,回答下列问题。
(1)N2O是一种能刺激神经使人发笑的气体,可发生分解反应2N2O=2N2+O2,碘蒸气能大幅度提高N2O的分解速率,反应历程为:
第一步: I2(g)=2I(g) (快反应)
第二步: I(g)+N2O(g)=N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)=N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_____(填标号)。
A.温度升高,该反应速率常数k值增大
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2作催化剂,其浓度大小与N2O分解速率无关
(2)温度为T1时,在二个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
容器编号 | 起始浓度/ mol·L-1 | 平衡浓度/ mol·L-1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
Ⅱ | 0.3 | 0.25 | 0.2 | |
①温度为T1时,![]() =________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
=________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
②容器Ⅱ中起始时v正_____v逆(填“>”“<”或“=”),理由是_______。
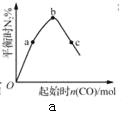
(3)NH3与CO2反应可合成尿素[化学式为CO(NH2)2],反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比
CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。
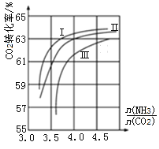
①曲线Ⅰ、Ⅱ、Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是______。
②在选择氨碳比时,工程师认为控制在4.0左右比较适宜,不选择4.5,理由是_____。