题目内容
【题目】下列图示与对应的叙述不正确的是( )
A.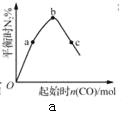 表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
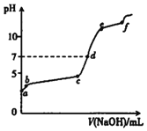
B.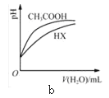 b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
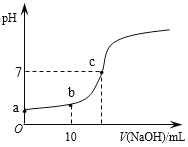
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D.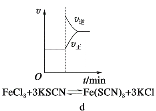 d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
【答案】D
【解析】
A. 增加CO的量,促使平衡向正反应方向进行,NO2的转化率增大,即c>b>a,故A说法正确;
B. 相同pH时,加水稀释相同倍数,酸性强的酸pH变化大,根据图像,CH3COOH的酸性强于HX,即HX的电离平衡常数小于CH3COOH的电离平衡常数,故B说法正确;
C. 根据反应方程式,增大压强,促使平衡向正反应方向进行,A的转化率增高大,根据图像p1>p2,故C说法正确;
D. 该反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3,加入少量KCl固体,对平衡移动无影响,故D说法错误;
Fe(SCN)3,加入少量KCl固体,对平衡移动无影响,故D说法错误;
答案:D。

练习册系列答案
相关题目
【题目】如下图所示,下列关于实验现象的描述正确的是( )

a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D