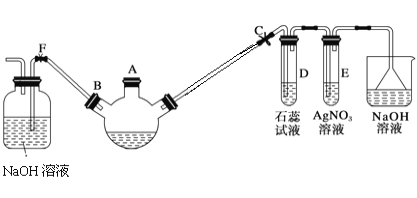
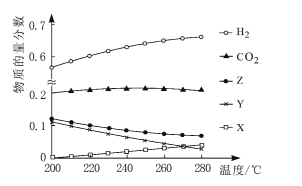
题目内容
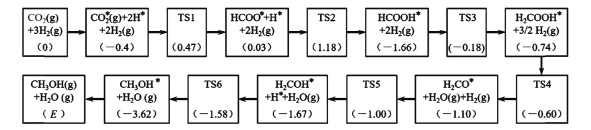
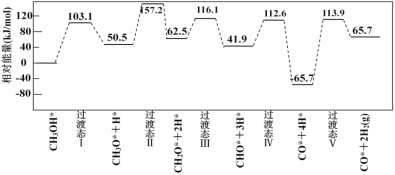
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O = 2Fe2+ + 4SO42 + 4H+。实现该反应的物质间转化如图所示。下列分析正确的是

A.反应Ⅰ中Fe(NO)2+作氧化剂
B.在酸性条件下,黄铁矿催化氧化中NO作中间产物
C.由反应Ⅱ可知,氧化性:Fe3+>SO42
D.反应Ⅲ的离子方程式为Fe2+ + NO =Fe(NO)2+,该反应是氧化还原反应
【答案】C
【解析】
步骤Ⅰ中,O2将Fe(NO)2+氧化为Fe3+,并释放出NO;Ⅱ中Fe3+将FeS2氧化成SO42,生成的Fe2+在Ⅲ中又与NO结合生成Fe(NO)2+,进入下一过程,总效果为:FeS2+O2+2H2O=2Fe2++ 4SO42+4H+,NO的量不变。
A.反应Ⅰ的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O,铁元素和化合价从+2升高到+3价,Fe(NO)2+作还原剂,故A错误;
B.由图可以看出,加入的NO参与反应,又重新生成,前后没有发生量的变化,所以在酸性条件下,铁矿催化氧化中NO作催化剂,故B错误;
C.Ⅱ中Fe3+将FeS2氧化成SO42,氧化剂的氧化性大于氧化产物,故Fe3+>SO42,故C正确;
D.反应Ⅲ的离子方程式为Fe2+ + NO =Fe(NO)2+,化合价没有发生变化,该反应是非氧化还原反应,故D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目