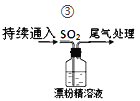
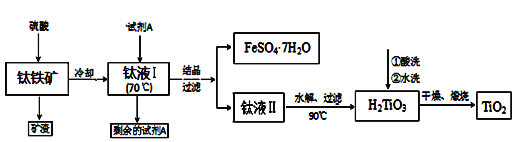
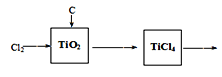
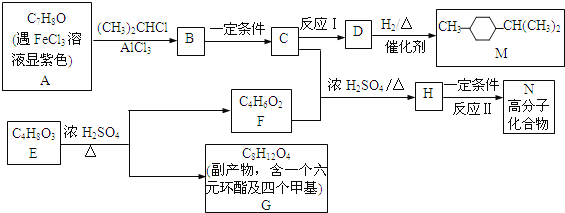
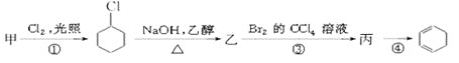
【题目】某学生对SO2与漂粉精的反应进行实验探究,下列叙述错误的是
操作 | 现象 |
①取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
②过滤,测漂粉精溶液的pH | pH试纸先变蓝,最后褪色 |
| 液面上方出现白雾;稍后,出现浑浊,溶液变为黄绿色;最终,产生大量白色沉淀,黄绿色褪去。 |
A.Cl2和Ca(OH)2制取漂粉精的化学方程式是:2Cl2+2Ca(OH)2 →CaCl2+Ca(ClO)2+2H2O
B.pH试纸颜色的变化说明漂粉精溶液具有碱性、漂白性
C.液面上方出现白雾,白雾中一定只含HCl
D.最后,产生大量白色沉淀,黄绿色褪去,推测白色沉淀主要是CaSO4