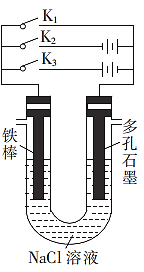
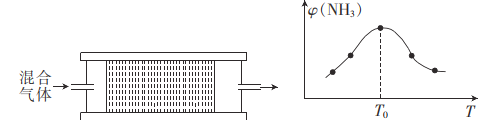
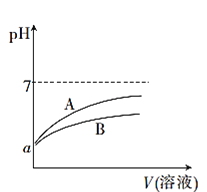
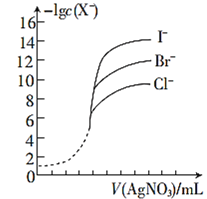
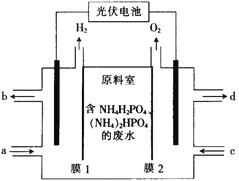
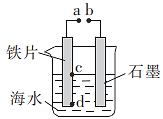
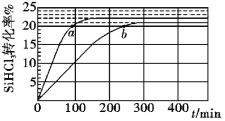
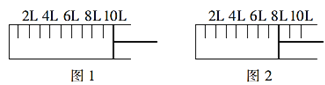0 202768 202776 202782 202786 202792 202794 202798 202804 202806 202812 202818 202822 202824 202828 202834 202836 202842 202846 202848 202852 202854 202858 202860 202862 202863 202864 202866 202867 202868 202870 202872 202876 202878 202882 202884 202888 202894 202896 202902 202906 202908 202912 202918 202924 202926 202932 202936 202938 202944 202948 202954 202962 203614