题目内容
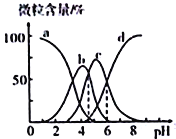
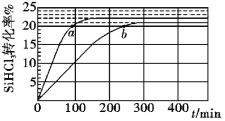
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,对于反应2SiHCl3(g)![]() SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
A.该反应的正反应活化能大于逆反应活化能
B.a、b处反应速率大小:va大于vb
C.温度一定时使用更优质催化剂,可使k正、k逆增大,k正与k逆的比值增大
D.343K时反应的平衡常数K=![]()
【答案】C
【解析】
根据达到平衡所需时间可知a所在曲线的温度更高,故a所在曲线的温度为343K,b所在曲线的温度为323K,进一步分析可知温度越高SiHCl3的转化率越高,即温度升高平衡右移,正反应吸热,![]() >0;
>0;
A. 根据分析可知![]() =正反应活化能-逆反应活化能>0,故A正确;
=正反应活化能-逆反应活化能>0,故A正确;
B.根据分析可知a点温度高于b点,温度越高反应速率越快,故B正确;
C. v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,反应达到平衡时正逆反应速率相等,即k正x2SiHCl3= k逆xSiH2Cl2xSiCl4,经变换可得平衡常数K=k正/k逆,即温度不变k正与k逆的比值不变,故C错误;
D. 由图示可知343K时反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的平衡转化率α=22%,设SiHCl3的起始浓度为cmol/L,则

平衡常数![]() =
=![]() ;故D正确;
;故D正确;
故答案为C。

【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手_______,右手摇动锥形瓶,眼睛 _____________滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:____________,即到终点,读出体积并记录。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a、滴定管在盛装标准NaOH溶液前未润洗
b、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c、达到滴定终点时,俯视溶液凹液面最低点读数
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________(结果保留三位小数)。