题目内容
【题目】回答下列问题:
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g) H=-92.4kJ·mol-1。现将6molN2和14molH2充入如图所示密闭容器中,保持压强不变,开始时活塞的位置如图1所示,当反应达到平衡时,活塞的位置如图2所示。
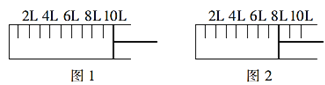
①下列表述能说明反应已达到平衡的是___(填字母)。
A.活塞不再移动
B.容器内压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均相对分子质量不再改变
②已知某次反应过程中逆反应速率随时间的变化关系如图所示,在t1时刻改变了某一条件,则改变的一种条件是_____。

(2)治理NO的一种方法是先将NO氧化成NO2后,再将NO2通入还原性碱溶液中电解转化成N2,其中氧化的反应原理为NO(g)+O3(g)NO2(g)+O2(g) H<0。下列说法正确的是____(填字母)。
A.已知该反应在较低温度下能自发进行,说明S=0
B.加入催化剂,可降低反应的活化能和焓变,从而加快反应的速率
C.活化分子有效碰撞理论中,活化能指活化分子平均能量与非活化分子平均能量的差值
D.在一定温度下,向恒容密闭容器中充入物质的量之比为1:3的NO和O3,达到平衡时NO转化率为a,再充入一定量物质的量之比为1:3的NO和O,NO转化率不变。
(3)处理汽车尾气中的氮氧化物还可以用NH3还原法,假设在恒容密闭容器中,仅发生反应:![]() △H<0。测得NO的平衡转化率随温度的变化关系如图所示,已知温度为T3时,反应达到平衡所需时间为10min。请在图中画出不同温度下(其他条件均相同),反应都经过10min时,NO转化率的曲线示意图_____________。
△H<0。测得NO的平衡转化率随温度的变化关系如图所示,已知温度为T3时,反应达到平衡所需时间为10min。请在图中画出不同温度下(其他条件均相同),反应都经过10min时,NO转化率的曲线示意图_____________。

【答案】ACD 加压 D 
【解析】
(1)①分析所给物理量在反应过程中是否发生变化,若反应过程中发生变化,当其不变时,则达到平衡状态;
②根据图像分析影响速率的因素;
(2)反应能否自发进行,依据△G=△H -T![]() △S<0;催化剂对反应速率的影响但是不影响反应热;活化能的考查;外界条件对平衡的影响;
△S<0;催化剂对反应速率的影响但是不影响反应热;活化能的考查;外界条件对平衡的影响;
(3)根据温度对化学反应速率、化学平衡的影响效果作图。
(1)①A.该反应为体积变化的反应,反应过程中气体的体积发生变化,因此活塞不再移动时,说明反应达到平衡状态,A正确;
B.该装置为恒压装置,反应过程中压强始终不变,B错误;
C.由于反应物和生成物都是气体,则混合气体的质量不变,由于容器为恒压装置,反应过程中,气体体积发生变化,根据公式![]() 可知,当混合气体的密度不变时,则反应达到平衡状态,C正确;
可知,当混合气体的密度不变时,则反应达到平衡状态,C正确;
D.该反应前后为气体分子数改变的反应,当容器内气体的平均相对分子质量不再改变时。反应达到平衡,D正确;
答案选ACD;
②由图可知,t1时刻后,反应速率增大,而升高温度、增大压强或加入催化剂都可能增大反应速率,若t1时刻反应达到平衡,则改变的条件为加压;
(2)A.该反应的H<0,依据△G=△H -T![]() △S<0可知,该反应在较低温度下自发进行,则△S<0,A错误;
△S<0可知,该反应在较低温度下自发进行,则△S<0,A错误;
B.催化剂降低反应的活化能,加快化学反应速率,不改变化学反应的焓变,B错误;
C.活化能是活化分子的平均能量与反应物分子的平均能量之间的差值,C错误;
D.该反应是反应前后气体分子数不变的反应,恒温恒容容器中反应达到平衡状态,同等倍数的增大反应物的浓度,当再次达到平衡时,NO转化率不变,D正确;
答案选D;
(3)反应进行前10min内,反应向正向进行,因此NO的转化率增大,由于升高温度,反应速率加快,达到平衡所需要的时间缩短,所以温度低于T3时,10min内反应均未达到平衡,NO的转化率低于其平衡状态的转化率,即在平衡转化率曲线下方,图像为: