【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应: 2NO(g)+2CO(g)N2(g)+2CO2(g)
(1)已知N2(g)+O2(g)2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=_____kJ/mol。
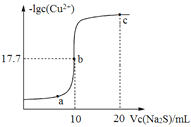
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示:
①该反应的平衡常数 K 的计算式为_____;前 10 分钟内用氮气表示的反应速率为_____。
②若保持温度不变,15 分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的ν正______ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min 时压缩容器的体积至 0.5L,20 分钟时反应重新达到平衡,NO 的浓度对应的点应是图中的_____(填字母)。
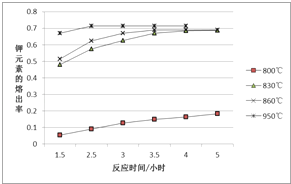
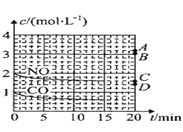
④某科研小组研究发现以 Ag-ZSM-5 为催化剂,NO 转化为 N2 的转化率随温度变化情况如图所示。若不使用 CO,温度超过775K,发现NO的分解率降低,其可能的原因是__________________
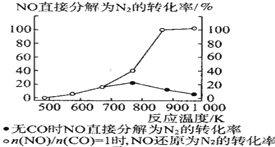
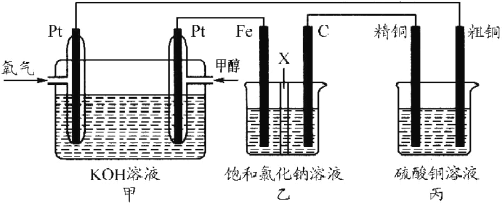
Ⅱ.利用电化学原理,将 NO2、O2和熔融 KNO3制成燃料电池,其原理如图,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅰ附近发生的反应电极反应式为_____相同条件下,消耗的 O2和 NO2的体积比为_____
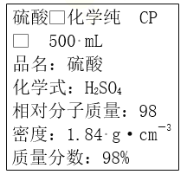
【题目】乙二酸俗称草酸(结构简式为HOOC﹣COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
填空:
(1)写出H2C2O4的电离方程式_______.
(2)KHC2O4溶液显酸性的原因是_____;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.c(K+)=c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)
b.c(Na+)=c(H2C2O4)+c(C2O42﹣)
c.c(K+)+c(Na+)=c(HC2O4﹣)+c(C2O42﹣)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是_______.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究________,但该实验始终没有看到溶液褪色,推测原因_______.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式________.
【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的 V2O5对反应 I 的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

写出 V2O5·SO3参加反应Ⅲ的化学方程式_____。
(2)将 2molSO2和 1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)。平衡时 SO3的体积分数(% )随温度和压强的变化如表所示:
1.0 | 2.0 | 3.0 | |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
下列判断正确的是______________
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入 V2O5作催化剂能加快反应速率,提高 SO3 的体积分数
D.平衡常数 K(550℃)>K(350℃)
(3)较纯的 SO2,可用于原电池法生产硫酸。图中离子交换膜是___________离子交换膜(填“阴”、“阳”)

(4)研究发现含碱式硫酸铝的溶液与SO2 结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如图所示:

请解释曲线如图变化的原因____
(5)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是________________
A.  B.
B.  C.
C.  D.
D. 
(6)用 Na2SO3 溶液作为吸收液吸收 SO2 时,产物为 NaHSO3,已知亚硫酸的两级电离平衡常数分别为 K a1、K a2。则常温下 NaHSO3溶液显酸性的充要条件为_____。(用含为 Ka1、Ka2 的代数式表示)