题目内容
【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的 V2O5对反应 I 的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

写出 V2O5·SO3参加反应Ⅲ的化学方程式_____。
(2)将 2molSO2和 1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)。平衡时 SO3的体积分数(% )随温度和压强的变化如表所示:
1.0 | 2.0 | 3.0 | |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
下列判断正确的是______________
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入 V2O5作催化剂能加快反应速率,提高 SO3 的体积分数
D.平衡常数 K(550℃)>K(350℃)
(3)较纯的 SO2,可用于原电池法生产硫酸。图中离子交换膜是___________离子交换膜(填“阴”、“阳”)

(4)研究发现含碱式硫酸铝的溶液与SO2 结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如图所示:

请解释曲线如图变化的原因____
(5)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是________________
A.  B.
B.  C.
C.  D.
D. 
(6)用 Na2SO3 溶液作为吸收液吸收 SO2 时,产物为 NaHSO3,已知亚硫酸的两级电离平衡常数分别为 K a1、K a2。则常温下 NaHSO3溶液显酸性的充要条件为_____。(用含为 Ka1、Ka2 的代数式表示)
【答案】2V2O4SO3+O22V2O5+2SO3 A 阳 SO2先与活泼氧化铝结合成亚硫酸铝,此时溶液中Al3+水解使溶液显酸性,后SO2与水结合生成H2SO3,亚硫酸电离使溶液显酸性,且亚硫酸电离强于Al3+的水解 BD Ka1·Ka2>10-14
【解析】
(1)反应Ⅲ是V2O4SO3与氧气反应生成V2O5和SO3;
(2)已知2SO2(g)+O2(g)2SO3(g)△H<0,结合温度和压强对平衡的影响分析即可。
(3)通氧气的极为正极,发生的电极反应为O2+4e-+4H+=2H2O;
(4)曲线体现随SO2的量增大,溶液的酸性增强,结合亚硫酸铝和亚硫酸溶液的酸性强弱分析;
(5)在恒容状态下,在五个相同的容器中同时通入等量的SO3,反应相同时间.达到平衡状态之前,温度越高,反应速率越大,导致SO3的百分含量越小;达到平衡后,因为该反应是放热反应,升高温度,平衡向逆反应方向移动,SO3的百分含量随温度升高而升高;在D图中转折点为平衡状态,转折点左侧为平衡状态之前,右侧为平衡状态;
(6)用 Na2SO3 溶液作为吸收液吸收 SO2 时,产物为 NaHSO3,当溶液中HSO3-的电离程度大于HSO3-的水解程度时溶液显酸性。
(1)反应Ⅲ是V2O4SO3与氧气反应生成V2O5和SO3反应Ⅱ生成V2O4SO3,方程式为2V2O4SO3+O22V2O5+2SO3,
(2)已知2SO2(g)+O2(g)2SO3(g)△H<0;
A.在350℃时,增大压强平衡正向移动,SO3的体积分数增大,则b>54.0%;而在恒压条件下升高温度,平衡逆向移动,则550℃时e<54.0%,即b>e,故A正确;
B.415℃、2.0MPa时设O2的转化率为x,则:
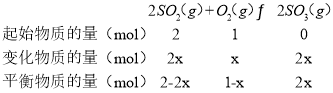
此时SO3的体积分数为40.0%,即![]() =40.0%,解得:x=50%,故B错误;
=40.0%,解得:x=50%,故B错误;
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,但不改变平衡的移动,则无法提高 SO3 的体积分数,故C错误;
D.平衡常数只受温度影响,升高温度时平衡逆向移动,则K(550℃)<K(350℃),故D错误;
故答案为A;
(3)电极b周围通入空气,氧气发生还原反应,则b极为正极,发生的电极反应为O2+4e-+4H+=2H2O,说明b极需要消耗H+,而阳离子向正极移动,则离子交换膜为阳离子交换膜;
(4)曲线体现随吸收SO2的量增大,溶液的酸性增强,且吸收一定量SO2后,溶液的pH迅速降低,说明SO2先与活泼氧化铝结合成亚硫酸铝,此时溶液中Al3+水解使溶液显酸性,随着只收SO2气体的量的增大,SO2与水结合生成H2SO3,亚硫酸电离使溶液显酸性,且亚硫酸电离强于Al3+的水解,此时溶液酸性明显增强,即溶液pH降低明显;
(5)A.因为该反应是放热反应,温度越高,平衡向逆反应方向移动,SO3的百分含量随温度升高而升高,故A错误;
B.因为该反应是放热反应,温度越高,平衡向逆反应方向移动,SO3的百分含量随温度升高而升高,故B正确;
C.若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的SO3转化得快,导致SO3的百分含量少的情况,不可能出现SO3的百分含量不变的情况,故C错误;
D.在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确;
故答案为:BD;
(6)在NaHSO3溶液中,![]() 的电离平衡为
的电离平衡为![]()
![]() +H+,
+H+,![]() 的水解平衡为H2O+
的水解平衡为H2O+![]() H2SO3+OH-,此时Kh=
H2SO3+OH-,此时Kh= =
=![]() ,当溶液中
,当溶液中![]() 的电离程度大于
的电离程度大于![]() 的水解程度时溶液显酸性,则Ka2>Kh=
的水解程度时溶液显酸性,则Ka2>Kh=![]() ,即Ka1·Ka2>Kw=10-14。
,即Ka1·Ka2>Kw=10-14。

【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
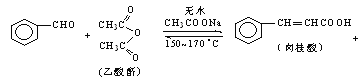 CH3COOH
CH3COOH
药品物理常数
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
沸点(℃) | 179.6 | 138.6 | 300 | 118 |
填空:
合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、苯甲醛和乙酸酐,振荡使之混合均匀. 在150~170℃加热1小时,保持微沸状态.
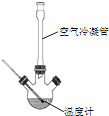
(1)空气冷凝管的作用是__.
(2)该装置的加热方法是__.加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是______.
(3)不能用醋酸钠晶体(CH3COONa3H2O)的原因是______.
粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
反应混合物![]()
![]()
![]()
![]()
![]() 肉桂酸晶体
肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是_______.
(5)操作I是__;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是__(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛_______.