题目内容
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)KCl(l)+NaAlSi3O8(s)+Q.填空:
(1)写出Cl原子的核外电子排布式____,NaCl的熔点比KCl______ (选填“高”或“低”).
(2)指出钾长石中存在的化学键类型______.
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是_____.
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量 占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得数据曲线如图.
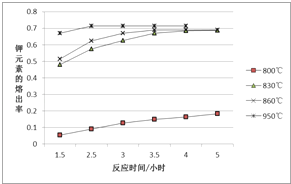
①分析数据可知,Q__0(选填“>”或“<”).
②950℃时,欲提高钾的熔出速率可以采取的措施是__(填序号).
a.延长反应时间
b.充分搅拌
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
③要使钾元素的熔出率和熔出速率都达到最大,反应温度应为__.
(5)工业上常用KCl冶炼金属钾.反应方程式为:Na(l)+KCl(l)NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:_________.
【答案】1s22s22p63s23p5 高 离子键和共价键 Na < bd 950℃ 将气态钾分离出来,降低了产物的浓度,平衡正向移动
【解析】
(1)氯原子的核外电子总数为17,根据构造原理写出其核外电子排布式;晶格能越大,离子晶体的熔点越高,据此分析解答;
(2)根据钾长石(KAlSi3O8)的组成分析判断;
(3)位于同周期元素有Na、Al、Si、Cl,结合各元素的最高价氧化物的水化物的性质分析判断;
(4)由图象中曲线变化可知,温度越高,钾元素的熔出率越高,结合温度对反应速率和化学平衡的影响分析解答;
(5)K为气态,将钾分离出来,可以降低了产物的浓度,结合浓度对化学平衡的影响分析解答。
(1)Cl所含质子数为17,原子核外电子数为17,根据核外电子的排布规律,核外电子排布式为1s22s22p63s23p5;离子晶体的晶格能大小取决于离子半径、电荷等因素,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,因为钾离子半径>钠离子半径,则熔点大小为:NaCl>KCl,故答案为:1s22s22p63s23p5;高;
(2)钾长石(KAlSi3O8)中即含有金属与非金属元素形成的离子键,也含有非金属元素之间形成的共价键,故答案为:离子键和共价键;
(3)上述反应涉及的位于同周期元素有Na、Al、Si、Cl,元素的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、硅酸、高氯酸,只有氢氧化钠能够与其余3种物质都反应,因此元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应的元素为Na,故答案为:Na;
(4)①由图象曲线数据可知,温度越高,钾元素的熔出率越高,说明升高温度,平衡向正反应方向移动,故正反应为吸热反应,Q<0,故答案为:<;
②a.延长反应时间,不能提高反应速率,故a错误;b.充分搅拌,能使反应物充分接触,反应速率加快,故b正确;c.该反应体系没有气体参加,增大反应体系的压强,物质的浓度不变,不能提高反应速率,故c错误;d.将钾长石粉粹成更小的颗粒,可以增大反应物的接触面积,反应速率加快,故d正确;故答案为:bd;
③根据图象可知,温度为950℃时熔出率和熔出速率都最高,故答案为:950℃;
(5)根据反应方程式可知,K为气态,将钾分离出来,可以降低产物的浓度,能够使平衡正向移动,故答案为:将气态钾分离出来,降低了产物的浓度,平衡正向移动。

【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________