题目内容
【题目】下列说法正确的是
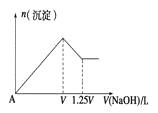
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=![]()
③将0.1mol·L-1的NaHS和0.1mol·L-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④B.②③C.③④D.①②
【答案】C
【解析】
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n在pH<=7的条件下成立,错误;②在硫酸钡的单一饱和溶液中式子成立,若向溶液中加入可溶性硫酸盐或可溶性钡盐,则式子不成立,错误;③根据溶液中电荷守恒和物料守恒得
c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-),2c(Na+)=3[c(S2-)+c(HS-)+ c(H2S)],两式结合消去c(Na+)即得,正确;④氨水与盐酸刚好完全中和时的产物是氯化铵,铵根离子水解,结合水电离产生的氢氧根离子使氢离子浓度大于氢氧根离子浓度,所以溶液中的氢离子也即水电离产生的氢离子,而水电离产生的氢离子与氢氧根离子浓度相等,所以c(OH-)=c(H+)=10-amol·L-1,正确,答案选C。

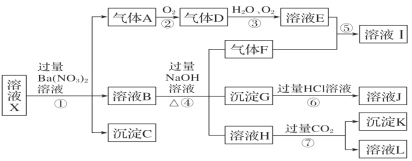
【题目】某菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3以及一些不反应的不溶性杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:

已知:MnCO3+2NH4Cl![]() MnCl2+CO2↑+2NH3↑+H2O
MnCl2+CO2↑+2NH3↑+H2O
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
开始沉淀时的pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
完全沉淀时的pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
(1)焙烧炉中生成的气体A的成分有__(填化学式)。
(2)气体A可用于制取纯碱,其制取过程如图所示:
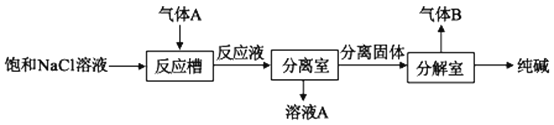
反应槽中有沉淀产生,该沉淀是__(填化学式),生成该沉淀的离子反应方程式为___,气体B的化学式为___。
(3)净化室中的除杂包含三步:
①加入少量MnO2将Fe2+转化为Fe3+,其反应的离子方程式为___;
②加氨水调pH=5.6,生成的沉淀的化学式是__;
③加入适量NH4F,将作为杂质的剩余金属阳离子转化为难溶于水的沉淀除去。
(4)净化液中含有的离子主要有__。
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
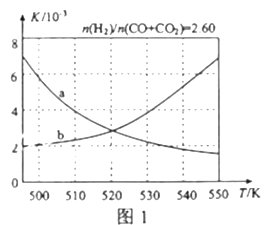
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.