题目内容
【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应: 2NO(g)+2CO(g)N2(g)+2CO2(g)
(1)已知N2(g)+O2(g)2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=_____kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示:
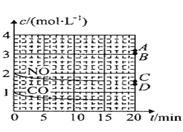
①该反应的平衡常数 K 的计算式为_____;前 10 分钟内用氮气表示的反应速率为_____。
②若保持温度不变,15 分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的ν正______ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min 时压缩容器的体积至 0.5L,20 分钟时反应重新达到平衡,NO 的浓度对应的点应是图中的_____(填字母)。
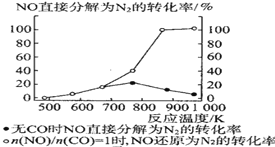
④某科研小组研究发现以 Ag-ZSM-5 为催化剂,NO 转化为 N2 的转化率随温度变化情况如图所示。若不使用 CO,温度超过775K,发现NO的分解率降低,其可能的原因是__________________
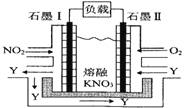
Ⅱ.利用电化学原理,将 NO2、O2和熔融 KNO3制成燃料电池,其原理如图,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅰ附近发生的反应电极反应式为_____相同条件下,消耗的 O2和 NO2的体积比为_____
【答案】-751 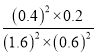 0.02mol/(Lmin) = B NO的分解反应为放热反应,升高温度有利于反应逆向进行 NO2-e-+NO3-═N2O5 1:4
0.02mol/(Lmin) = B NO的分解反应为放热反应,升高温度有利于反应逆向进行 NO2-e-+NO3-═N2O5 1:4
【解析】
(1)反应焓变=反应物总键能-生成物总键能;①N2(g)+O2(g)2NO(g);②2NO(g)+2CO(g)2CO2(g)+N2(g);①+②得:③2CO(g)+O2(g)2CO2(g),依据反应焓变=反应物总键能-生成物总键能计算该反应的焓变;依据盖斯定律②=③-①计算2NO(g)+2CO(g)2CO2(g)+N2(g)△H;
(2)①依据方程式2NO(g)+2CO(g)2CO2(g)+N2(g),结合图象,列三段,表示出平衡时各物质的物质的量浓度,依据平衡常数表达式解答;v(N2)=![]() 计算10min内N2平均反应速率;
计算10min内N2平均反应速率;
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,计算此时,反应的浓度商与K比较判断反应进行方向;
③若保持其条件不变,15min时压缩容器至0.5L时,加压平衡逆向移动;
④依据2NO(g)+2CO(g)2CO2(g)+N2(g)△H<0,可知反应为放热反应,升高温度平衡逆向移动;
(3)该燃料电池中,负极上通入NO2,正极上通入O2,根据电解质知,负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-,据此分析解答。
(1)反应焓变=反应物总键能-生成物总键能,则③2CO(g)+O2(g)2CO2(g),△H3=497+2×1072-803×4=-571kJ/mol;依据盖斯定律:③2CO(g)+O2(g)2CO2(g)△H3=-571kJ/mol;①N2(g)+O2(g)2NO(g)△H=+180kJ/mol;则③-①得:②2NO(g)+2CO(g)2CO2(g)+N2(g),则其焓变值△H2=△H3-△H1=-571-180=-751kJ/mol;
(2)①在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)2CO2(g)+N2(g)达到平衡状态,由图象1可知,平衡时CO物质的量度为0.6mol/L,则:
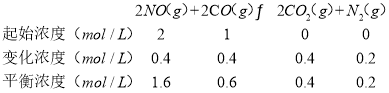
该反应平衡常数表达式K=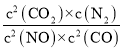 =
=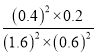 ;10min内N2平均反应速率v(N2)=
;10min内N2平均反应速率v(N2)=![]() =
=![]() =0.02mol/(Lmil);
=0.02mol/(Lmil);
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则:此时:C(NO)=3.2mol/L;C(CO)=0.6mol/L;C(CO2)=0.8mol/L;C(N2)=0.2mol/L;反应的浓度商为: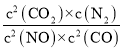 =
=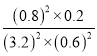 =
=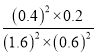 ,说明反应达到平衡,则V正=V逆;
,说明反应达到平衡,则V正=V逆;
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,加压平衡逆向移动,一氧化氮浓度增加,依据可逆反应特点,利用极值可知当CO全部反应,则平衡后一氧化氮浓度为3mol/L,所以一氧化氮浓度应介于2mol/L和mol/L之间,故答案为B;
④依据2NO(g)+2CO(g)2CO2(g)+N2(g)△H<0,可知反应为放热反应,升高温度平衡逆向移动,有利于反应逆向进行;
(3)该燃料电池中,负极上通入NO2,石墨Ⅰ为负极,电极反应式为NO2-e-+NO3-═N2O5,正极上通入O2,石墨Ⅱ为正极,电极反应式为O2+2N2O5+4e-═4NO3-,所以NO3-向负极移动,即NO3-向石墨Ⅰ;依据O2+2N2O5+4e-═4NO3-,可知1mol氧气得到4mol电子,依据NO2-e-+NO3-═N2O5,1mol二氧化氮失去1mol电子,要使得失电子守恒:则消耗的O2和 NO2的体积比为1:4。