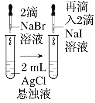
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
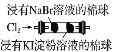
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D
【题目】下列有关水溶液中的平衡相关的问题,请填空
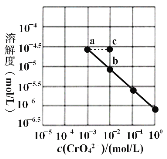
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
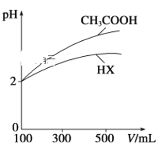
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。