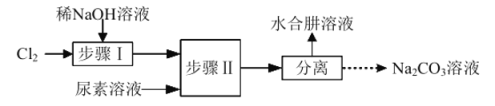
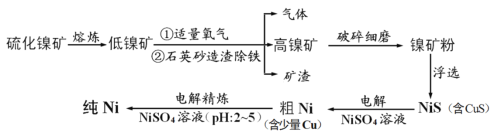
题目内容
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
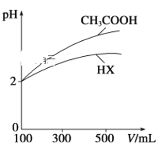
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
【答案】2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑ > 碱性 > 18 = ![]()
【解析】
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,是铝离子和碳酸根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳;
(2)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,酸的电离平衡常数越大,酸的电离程度越大,则酸根离子水解程度越小,根据电荷守恒判断;
(3)①NaCN溶液中CN-离子水解溶液显碱性,计算水解平衡常数和HCN电离平衡常数比较判断溶液酸碱性和离子浓度关系;
②25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,溶液显酸性,说明醋酸电离程度大于醋酸根离子水解程度;
(4)电荷守恒,判断离子浓度大小;氨水的电离平衡常数为电离出离子的浓度积与溶质浓度的比值。
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,是铝离子和碳酸根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑,故答案为:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑;
(2)据图分析,加水稀释的过程中,HX的pH变化比较小,说明HX的酸性比醋酸弱,HX的电离平衡常数比醋酸小,溶液中存在电荷守恒,根据电荷守恒得c(CH3COO)+c(OH)=c(Na+)+c(H+)、c(X)+c(OH)=c(Na+)+c(H+),所以溶液中所有离子浓度为阳离子浓度的2倍,醋酸的电离程度大于HX,醋酸根离子水解程度小于X根离子,所以醋酸钠溶液中氢离子浓度大于NaX,则醋酸钠溶液离子数目较多,故答案为:>;
(3)①25℃时,浓度均为0.01molL1HCN和NaCN混合溶液,CN+H2OHCN+OH,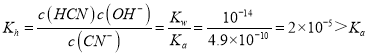 ,水解程度大于酸的电离程度,溶液显碱性,溶液中HCN浓度大于CN浓度,故答案为:碱性;>;
,水解程度大于酸的电离程度,溶液显碱性,溶液中HCN浓度大于CN浓度,故答案为:碱性;>;
②25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,溶液显酸性,说明醋酸电离程度大于醋酸根离子水解程度,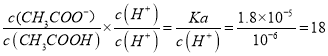 ,故答案为:18;
,故答案为:18;
(4)电荷守恒:c(NH4+)+c(H+)=c(Cl)+c(OH),溶液呈中性,即c(H+)=c(OH),即c(NH4+)=c(Cl),氨水中的电离常数为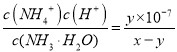 ,故答案为:=;
,故答案为:=;![]() 。
。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___,B、C、N、O第一电离能由大到小的顺序为___,CH4、H2O、CO2的键角按照由大到小的顺序排列为___。
(2)与(HB=NH)3互为等电子体的有机分子为___(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
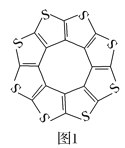
①C16S8分子中C原子和S原子的杂化轨道类型分别为___。
②相关键长数据如表所示:
化学键 | C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___。
③C16S8与H2微粒间的作用力是___。
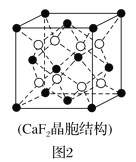
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___。
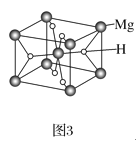
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(2)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
A.Ba(OH)2溶液 | B.BaCl2溶液 |
C.NaOH溶液 | D.澄清的石灰水 |
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。