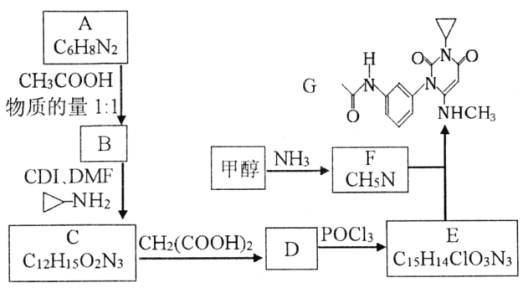
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


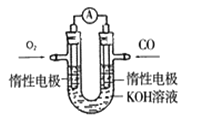
ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
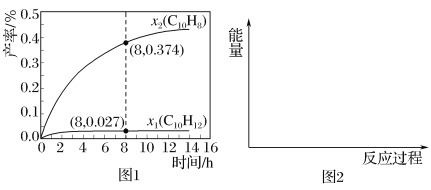
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
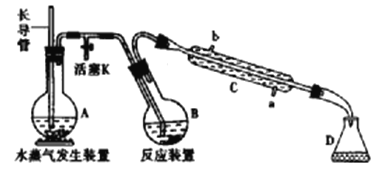
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
【题目】电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
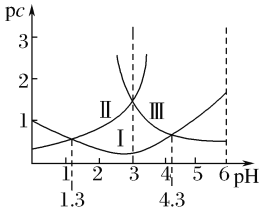
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_____________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。