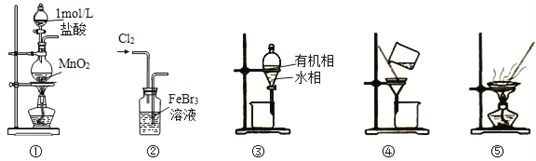
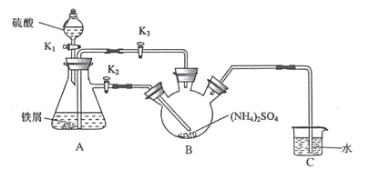
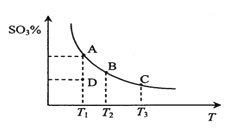
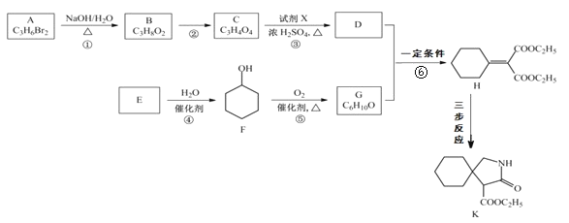
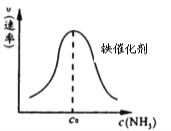
0 202622 202630 202636 202640 202646 202648 202652 202658 202660 202666 202672 202676 202678 202682 202688 202690 202696 202700 202702 202706 202708 202712 202714 202716 202717 202718 202720 202721 202722 202724 202726 202730 202732 202736 202738 202742 202748 202750 202756 202760 202762 202766 202772 202778 202780 202786 202790 202792 202798 202802 202808 202816 203614