【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液+1 mL H2O | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+1 mL HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+1 mL NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是____。
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:__,该反应是____反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与____有关。
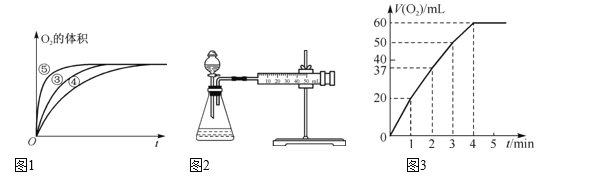
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:__,计算H2O2的初始物质的量浓度为____。(保留两位有效数字)
【题目】将一定量纯净的氨基甲酸铵固体置于恒容的密闭真空容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/ 10-3mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法正确的是
A. 该反应在低温下可以自发进行
B. 当体系中气体的平均相对分子质量不变时,说明该反应达到了平衡状态
C. 恒温条件下,向容器中再充入2mol NH3和1molCO2,平衡向左移动,平衡后,NH3的浓度减小
D. 15℃时,该反应的平衡常数约为2.05×10-9