题目内容
【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液+1 mL H2O | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+1 mL HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+1 mL NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________(写出一种即可)。
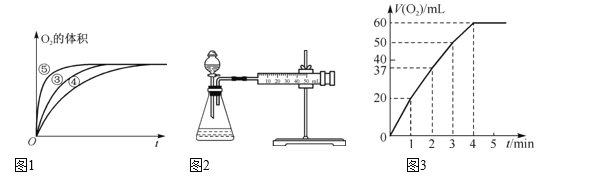
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是____。
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:__,该反应是____反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:__,计算H2O2的初始物质的量浓度为____。(保留两位有效数字)
【答案】探究反应物浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中) 碱性环境能增大H2O2的分解速率,酸性环境能减小H2O2的分解速率 2H2O2![]() 2H2O+O2↑ 放热 催化剂的接触面积 随着反应的进行,反应物浓度减小,反应速率减慢 0.11 mol·L-1
2H2O+O2↑ 放热 催化剂的接触面积 随着反应的进行,反应物浓度减小,反应速率减慢 0.11 mol·L-1
【解析】
Ⅰ.(1)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
Ⅱ. (1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;由实验现象可知,反应放热还是吸热;
(2)由实验现象可知催化剂作用大小的影响因素;
(3)随着反应的进行,反应物的浓度不断减小,据此分析原因;根据图象可以看出H2O2完全反应放出60 mL O2,根据化学方程式进行计算。
Ⅰ. (1)实验①和②的浓度不同,则该实验的目的为探究反应物浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中);
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,在酸性环境能减小H2O2分解的速率;
Ⅱ. (1)H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
;根据触摸试管的感觉可知,该反应为放热反应;
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明催化剂的接触面积对反应速率有影响,故答案为:催化剂的接触面积;
(3)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2![]() 2H2O+O2↑,则:n(H2O2)=
2H2O+O2↑,则:n(H2O2)=![]() ≈0.00536 mol,
≈0.00536 mol,
所以H2O2的初始物质的量浓度为:c(H2O2)=![]() ≈0.11 mol/L,
≈0.11 mol/L,
故答案为:随着反应的进行,反应物浓度减小,反应速率减慢;0.11 mol·L-1。

【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D