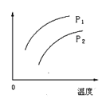
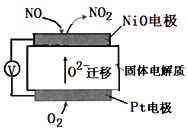
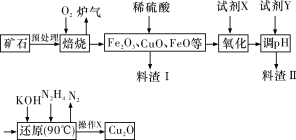
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________(填化学式),Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,则“氧化”反应的离子方程式为____________________,并写出H2O2的电子式:__________;当试剂X是__________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是__________。
(4)操作X包括__________、洗涤、烘干,其中烘干时要隔绝空气,其目的是_________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:____________________________________。
【题目】已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgCl)=1.5×10-16。某研究性学习小组探究AgCl、Ag2S沉淀转化的原因。
步骤 | 现象 |
Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 在空气中放置较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是__。
(2)Ⅱ中能说明沉淀变黑的离子方程式是__。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,沉淀部分溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y中滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是__。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀__。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
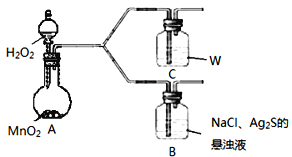
现象 | B:一段时间后,出现乳白色沉淀 |
C:一段时间后,无明显变化 |
①A中产生的气体是___。
②C中盛放的物质W是__。
③该同学认为B中产生沉淀的反应如下(请补充完整):__
2Ag2S+__+__+2H2O=4AgCl+__+4NaOH
④从溶解平衡移动的角度,解释B中NaCl的作用__。
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废液(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如图:
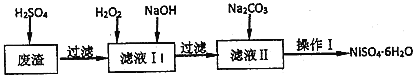
已知: 25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有________。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液I中加入6%的H2O2,其作用是__________(用离子方程式表示);加入NaOH调节pH的范围是_________,为了除去溶液中的_________离子。
(3)检验Ni2+已完全沉淀的实验方法是_________________。