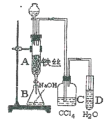
题目内容
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)2C(g);ΔH>0(表示吸热)。平衡移动关系如图所示,下列说法正确的是( )
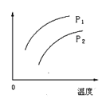
A.P1>P2,纵坐标指C的质量分数B.P1<P2,纵坐标指A的质量分数
C.P1<P2,纵坐标指A的转化率D.P1<P2,纵坐标指混合气体的平均摩尔质量
【答案】A
【解析】
根据题中A(g)+2B(g)2C(g);ΔH>0(表示吸热)可知,本题考查化学平衡的影响因素,运用勒夏特列原理分析。
A(g)+2B(g)2C(g)△H>0,为气体体积减小且放热的可逆反应,压强增大平衡正向移动,
A.P1>P2,压强增大平衡正向移动,C的质量分数增大,温度升高平衡正向移动,C的质量分数增大,则与图象符合,故A正确;
B.P1<P2,压强增大平衡正向移动,A的质量分数减小,温度升高平衡正向移动,A的质量分数减小则与图象不符合,故B错误;
C.P1<P2,压强增大平衡正向移动,A的转化率增大,则纵坐标不能为A的转化率,故C错误;
D. 由反应可知反应前后气体的总质量不变,P1<P2,压强增大平衡正向移动,总物质的量减小,则混合气体的平均摩尔质量增大,与图象不符,故D错误;
答案选A。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废液(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如图:
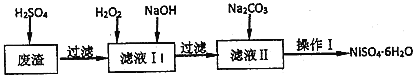
已知: 25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有________。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液I中加入6%的H2O2,其作用是__________(用离子方程式表示);加入NaOH调节pH的范围是_________,为了除去溶液中的_________离子。
(3)检验Ni2+已完全沉淀的实验方法是_________________。