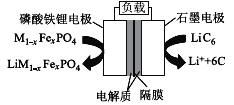
题目内容
【题目】下列关于溶液物质的量浓度的说法正确的是( )
A.常温下,1L水中溶解58.5gNaCl,该溶液的物质的量浓度为1molL﹣1
B.标准状况下,将22.4L HCl溶于1L水,可配成1molL﹣1的稀盐酸
C.将4.0g NaOH倒入100mL容量瓶中,加水至刻度线,即可配成1molL﹣1的NaOH溶液
D.10g 98%的硫酸(密度为1.84gcm﹣3)与10mL 18.4molL﹣1的硫酸的浓度相同
【答案】D
【解析】
根据题中物质的量浓度可知,本题考查物质的量浓度的相关计算,运用![]() 分析。
分析。
A.1L水中溶解了58.5g NaCl,物质的量![]() ,溶液体积不是1L,该溶液的物质的量浓度不是1mol/L,故A错误;
,溶液体积不是1L,该溶液的物质的量浓度不是1mol/L,故A错误;
B.HCl的物质的量为1mol,溶液体积大于1L,所以配制溶液浓度小于1mol/L,故B错误;
C. 容量瓶不能溶解或稀释药品,应该将NaOH在烧杯中溶解,冷却后转移至容量瓶中,加水至1~2cm处用胶头滴管滴加水至刻度线处,故C错误;
D. 结合![]() 可知,98%硫酸(密度为1.84gcm﹣3)的物质的量浓度
可知,98%硫酸(密度为1.84gcm﹣3)的物质的量浓度![]() ,与10mL18.4molL﹣1硫酸的浓度是相同的,故D正确;
,与10mL18.4molL﹣1硫酸的浓度是相同的,故D正确;
答案选D。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目