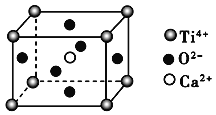
【题目】某同学探究 Cu 与 NO 的反应,查阅资料:①Cu 与 NO 反应可生成 CuO 和 N2,②酸性条件下,NO 或 NO2–都能与 MnO4–反应生成 NO3–和 Mn2+
(1)实验室利用Cu和稀 HNO3 制备 NO,写出反应的化学方程式____。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
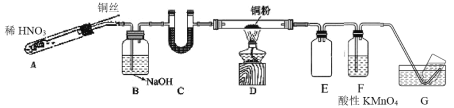
①使用铜丝的优点是____装置 E 的作用为____。
②装置 C 中盛放的药品可能是____;
③装置 D 中的现象是____;装置 F 中反应的离子方程式是____。
(3)测定NaNO2 和 NaNO3混合溶液中NaNO2的浓度。取 25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1 酸性 KMnO4 溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 KMnO4 溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是____(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.因为没有一直观察锥形瓶中溶液颜色变化,判断滴定终点时溶液已变红d.酸性 KMnO4 溶液中含有其他氧化性试剂e.锥形瓶洗净后用待测液润洗
②酸性 KMnO4溶液滴定亚硝酸钠溶液的离子方程式为____。
③NaNO2的物质的量浓度为____
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等