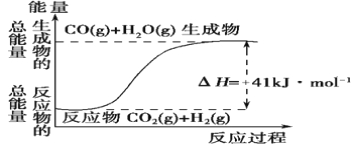
题目内容
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
【答案】 2C(石墨)+ 3H2(g)=C2H6(g) △H=-86.4kJ/mol c 800 小于 2NO2-+6e-+4H2O= N2+ 8OH- 22.4L 该反应的K=Ksp·Kβ=1.6×10-7<10-5所以反应很难进行 固体溶解,得到深蓝色溶液 溶液中存在平衡Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动
[Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动
【解析】本题考查盖斯定律的应用,②×2+③×3/2-①/2得出:2C(石墨)+ 3H2(g)=C2H6(g) △H=-86.4kJ/mol;(2)①恒容绝热容器,正反应是放热反应,随着反应进行,温度升高,化学反应速率升高,先达到平衡,符合条件的曲线是c;② 此反应是气体物质的量减少的,恒温恒容是的反应速率小于恒温恒压,即b为恒温恒容时的曲线,a为恒温恒压时的曲线,化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,即N2+3H2![]() 2NH3
2NH3
起始(mol·L-1) 0.5 1.4 0
变化: 0.4 1.2 0.8
平衡: 0.1 0.2 0.8 根据化学平衡常数的定义,K=c2(NH3)/(NH3)/[c3(H2)×c(N2)]=800;③M点达到b曲线上,N2的转化率降低,说明反应向逆反应方向移动,即v(正)<v(逆);(3)根据电解的原理,阴极上得到电子,化合价降低,根据信息NO2-→N2,化合价由+3价→0价,NO2-在阴极上放电,因此阴极反应式为:2NO2-+4H2O+6e-=N2+8OH-,阳极上失去电子化合价升高,阴极上收集到11.2L的N2,消耗NO2-的物质的量11.2×2/22.4mol=1mol,NH3在阳极上失电子,根据得失电子守恒,n(NH3)×3=n(NO2-)×3,解得n(NH3)=1mol,合22.4L;(4)①根据平衡常数定义,K=c2(OH-)×c(Cu[NH3]4]2-)/c4(NH3·H2O)= c2(OH-)×c(Cu[NH3]4]2-)×c(Cu2+)/[c4(NH3·H2O) ×c(Cu2+)]=Ksp×Kβ=2.2×10-20×7.24×1012=1.6×10-7<10-5,此反应很难进行;②溶液中存在平衡Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动,现象是固体溶解,得到深蓝色溶液。
[Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动,现象是固体溶解,得到深蓝色溶液。

【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,请按要求回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | A | |||||||
二 | D | E | G | I | ||||
三 | B | C | F | H |
(1)A-I中元素,化学性质最不活泼的是______(用元素符号),还原性最强的单质是______(用元素符号);
(2)A-I中最高价氧化物的水化物酸性最强的酸是______(用化学式);
(3)用电子式表示D元素最高价氧化物的形成过程_______________________________ ;
D元素最高价氧化物的结构式为______
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式___________________ .
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
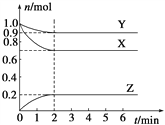
(1)该反应的化学方程式为_______________。
(2)反应开始至2 min,气体Z的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时,压强是开始时的________倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热ΔH=_____________。
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。已知:
化学键 | H—H | H—Cl | Cl—Cl |
键能/ kJ·mol–1 | 436 | 431 | 242 |
工业上通过氢气在氯气中充分燃烧制取HCl气体,写出该反应的热化学反应方程式:_______________。