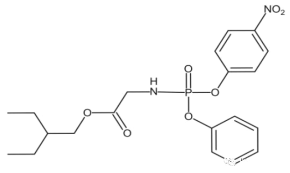
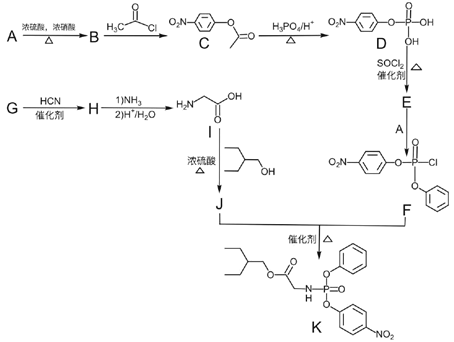
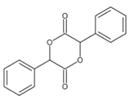
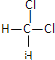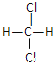��Ŀ����
����Ŀ����֪NH4Cl��Һ�д�������ƽ�⣺NH4+��aq��+H2O��l��![]() NH3��H2O��aq��+H+��aq������H>0���ش��������⣺
NH3��H2O��aq��+H+��aq������H>0���ش��������⣺
��1������Һ�м���Zn�ۣ�ƽ��___�ƶ�(����������������������������)�����ܳ��ֵ�������__��
��2�������¶ȣ�H+��Ũ��___������������������С����������������ƽ��___�ƶ�(����������������������������)��
��3������ѹǿ��ƽ��___�ƶ�(����������������������������)����Ӧ����___������������������С����������������
��4���÷�Ӧƽ�ⳣ���ı���ʽΪ___�������¶Ȳ����ټ���NH4Cl(aq)��ƽ�ⳣ��___������������������С����������������
���𰸡����� п���ܽ⣬�������� ���� ���� �� ���� ![]() ����
����
��������
NH4+(aq)+H2O(l)![]() NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�����Ӱ�컯ѧƽ������ط������
NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�����Ӱ�컯ѧƽ������ط������
(1)����Һ�м���Zn�ۣ�п�������ӷ�Ӧ�ų�������������Ũ�ȼ�С��ƽ�������ƶ����ʴ�Ϊ������п���ܽ⣬�������ݣ�
(2)NH4+(aq)+H2O(l)![]() NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���H+��Ũ�����ʴ�Ϊ����������
NH3��H2O(aq)+H+(aq)����H>0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���H+��Ũ�����ʴ�Ϊ����������
(3)�÷�Ӧ����Һ�н��У�����ѹǿ��ƽ�ⲻ�ƶ�����Ӧ���ʲ��䣬�ʴ�Ϊ���������䣻
(4)NH4+(aq)+H2O(l)![]() NH3��H2O(aq)+H+(aq)����H>0����Ӧ��ƽ�ⳣ���ı���ʽΪ
NH3��H2O(aq)+H+(aq)����H>0����Ӧ��ƽ�ⳣ���ı���ʽΪ![]() ���¶Ȳ��䣬ƽ�ⳣ�����䣬�ʴ�Ϊ��
���¶Ȳ��䣬ƽ�ⳣ�����䣬�ʴ�Ϊ��![]() �����䡣
�����䡣

����Ŀ�����仯������������;��������ʵ��������������ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | -85.5 | 115.2 | ��600(�ֽ�) | -75.5 | 16.8 | 10.3 |
�е�/�� | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Feԭ�Ӽ۲���ӵĵ����Ų�ͼ���������ʽ��Ϊ____________����̬Sԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____________�Ρ�
��2�����ݼ۲���ӶԻ������ۣ�H2S��SO2��SO3����̬�����У�����ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���____________��
��3��ͼ��a��ΪS2�Ľṹ�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ____________��
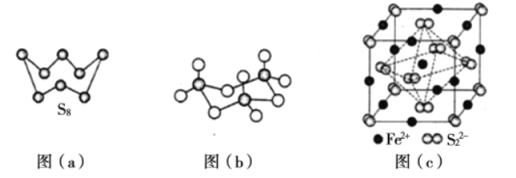
��4����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ____________�Σ����й��ۼ���������____________�֣��������������д�����ͼ��b����ʾ�����۷��ӡ��÷�����Sԭ�ӵ��ӻ��������Ϊ____________��
��5�� FeS2����ľ�����ͼ��c����ʾ�������߳�Ϊa nm�� FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ____________g��cm��3��������Fe2+λ��S22�����γɵİ���������ģ�����������ı߳�Ϊ____________nm��