【题目】某活动小组在实验室探究氨气的的制备方法,并测定其分子组成。
![]() 同学甲用下图所示装置制备氨气。
同学甲用下图所示装置制备氨气。
已知:加热![]() 和
和![]() 饱和溶液可以制取
饱和溶液可以制取![]() 。
。

(1)![]() 、D、G处的酒精灯最先点燃的是 ___________
、D、G处的酒精灯最先点燃的是 ___________![]() 填字母
填字母![]() 。
。
(2)写出B中制取![]() 的反应的离子方程式:__________。
的反应的离子方程式:__________。
(3)图示装置从左到右正确连接顺序:![]()
![]() ____
____![]() ____
____![]() ____
____![]() ____
____![]() 。
。
![]() 同学乙用下图所示装置
同学乙用下图所示装置![]() 夹持装置已省略
夹持装置已省略![]() 制备氨气,并与CuO反应测定氨气的组成。
制备氨气,并与CuO反应测定氨气的组成。

(1)同学乙在相同条件下,选择不同固体试剂制取氨气,实验数据如下:
实验方案 | 固体试剂 |
| |
1 |
|
| 1753 |
2 |
| 1892 | |
3 |
|
| 1354 |
4 |
| 1384 | |
分析表中数据,你认为哪种方案制取氨气的效果最好?________![]() 填序号
填序号![]() ,该方案制取氨气效果好的可能原因是_______________。
,该方案制取氨气效果好的可能原因是_______________。
(2)装置D的作用是______________________________________。
(3)实验结束后,若测得干燥管C增重![]() ,装置E中气体的体积为
,装置E中气体的体积为![]() 已折算为标准状况
已折算为标准状况![]() ,则氨分子中氮、氢的原子个数比为___________
,则氨分子中氮、氢的原子个数比为___________![]() 用含m、V的代数式表示
用含m、V的代数式表示![]() ;若测量时,发现E装置中液面左低右高,则测得的比值___________
;若测量时,发现E装置中液面左低右高,则测得的比值___________![]() 填“偏大”“偏小”或“不变”
填“偏大”“偏小”或“不变”![]() 。
。
【题目】CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)![]() C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。
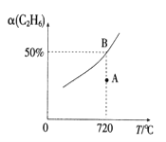
①在相应温度下,A点的反应速v(正)____v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________(任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)该反应为_________反应(填“吸热”、“放热”),原因为_________________。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________,转化率α(CO2)=___________。