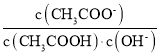题目内容
【题目】在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈_________色,因为_____________。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________方向移动(正或逆),溶液颜色将__________(加深或变浅)。
【答案】橙红 增大H+,平衡向逆反应方向移动 正反应方向移动 变浅
【解析】
(1) 根据Cr2O72-+H2O![]() 2CrO42-+2H+反应可知,加入浓硫酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,故答案为:橙红;增大H+,平衡向逆反应方向移动;
2CrO42-+2H+反应可知,加入浓硫酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,故答案为:橙红;增大H+,平衡向逆反应方向移动;
(2)因为BaCrO4为黄色沉淀,所以向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,平衡正向移动,溶液的颜色变浅,故答案为:正反应方向移动;变浅。

【题目】某活动小组在实验室探究氨气的的制备方法,并测定其分子组成。
![]() 同学甲用下图所示装置制备氨气。
同学甲用下图所示装置制备氨气。
已知:加热![]() 和
和![]() 饱和溶液可以制取
饱和溶液可以制取![]() 。
。

(1)![]() 、D、G处的酒精灯最先点燃的是 ___________
、D、G处的酒精灯最先点燃的是 ___________![]() 填字母
填字母![]() 。
。
(2)写出B中制取![]() 的反应的离子方程式:__________。
的反应的离子方程式:__________。
(3)图示装置从左到右正确连接顺序:![]()
![]() ____
____![]() ____
____![]() ____
____![]() ____
____![]() 。
。
![]() 同学乙用下图所示装置
同学乙用下图所示装置![]() 夹持装置已省略
夹持装置已省略![]() 制备氨气,并与CuO反应测定氨气的组成。
制备氨气,并与CuO反应测定氨气的组成。

(1)同学乙在相同条件下,选择不同固体试剂制取氨气,实验数据如下:
实验方案 | 固体试剂 |
| |
1 |
|
| 1753 |
2 |
| 1892 | |
3 |
|
| 1354 |
4 |
| 1384 | |
分析表中数据,你认为哪种方案制取氨气的效果最好?________![]() 填序号
填序号![]() ,该方案制取氨气效果好的可能原因是_______________。
,该方案制取氨气效果好的可能原因是_______________。
(2)装置D的作用是______________________________________。
(3)实验结束后,若测得干燥管C增重![]() ,装置E中气体的体积为
,装置E中气体的体积为![]() 已折算为标准状况
已折算为标准状况![]() ,则氨分子中氮、氢的原子个数比为___________
,则氨分子中氮、氢的原子个数比为___________![]() 用含m、V的代数式表示
用含m、V的代数式表示![]() ;若测量时,发现E装置中液面左低右高,则测得的比值___________
;若测量时,发现E装置中液面左低右高,则测得的比值___________![]() 填“偏大”“偏小”或“不变”
填“偏大”“偏小”或“不变”![]() 。
。