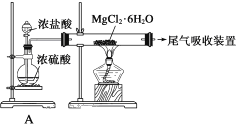
题目内容
【题目】已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1)FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL该溶液于锥形瓶中,用cmol/L的K2Cr2O7酸性溶液(用稀硫酸酸化)滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
【答案】 )Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ MgO或Mg(OH)2或MgCO3等 2.6×10-9 mol/L 在干燥的HCl气流中加热脱水 2Fe2++2H2C2O4+Cr2O72-+10H+=2Fe3++4CO2↑+2Cr3++7H2O
Fe(OH)3(胶体)+3H+ MgO或Mg(OH)2或MgCO3等 2.6×10-9 mol/L 在干燥的HCl气流中加热脱水 2Fe2++2H2C2O4+Cr2O72-+10H+=2Fe3++4CO2↑+2Cr3++7H2O ![]() 或
或![]() ×100% 或
×100% 或![]() %
%
【解析】本题主要考查铁的化合物的性质。
(1)FeCl3溶液可用做净水剂,其净水原理为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,Fe(OH)3胶体可以凝聚水中悬浮物。
Fe(OH)3(胶体)+3H+,Fe(OH)3胶体可以凝聚水中悬浮物。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入MgO或Mg(OH)2或MgCO3等调节溶液的pH=4,c(OH-)=1×10-10mol/L,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= =2.6×10-9 mol/L。
=2.6×10-9 mol/L。
(3)FeCl3可以水解,为了抑制FeCl3的水解由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:在干燥的HCl气流中加热脱水。
(4)①滴定时反应的离子方程式为2Fe2++2H2C2O4+Cr2O72-+10H+=2Fe3++4CO2↑+2Cr3++7H2O。
②该草酸亚铁样品的纯度为cmol/L×VmL×2×144g/mol×250/20/(wg)= ![]() 或
或![]() ×100% 或
×100% 或![]() %。
%。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
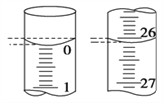
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。