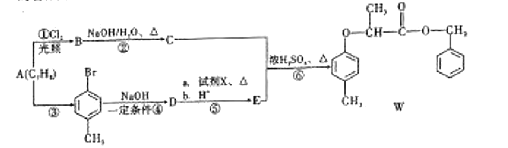
题目内容
【题目】一定温度下,向2L密闭容器中充入5molN2和7molH2。发生反应:N2(g)+3H2(g)![]() 2NH3(g)。请问答:
2NH3(g)。请问答:
(1)该反应的平衡常数表达式为___________
(2)一定温度下,不能说明上述反应已达到平衡的是____________(填选项字母)。
a.NH3的生成速率和NH3的分解速率相等
b.单位时间内消耗amolN2同时生成2amolNH3
c.容器内的压强不再变化
d.容器内的密度不再变化
e.容器内H2的体积分数不再变化
(3)当该反应达到平衡时,测得c(N2)=2.0mol/L,则该温度下反应的平衡常数K=_____。
(4)若在上述平衡条件下保持温度不变,将容器扩大到原来的两倍,再次达到平衡时N2(g)的转化率_______(填“增大”、“减小”或“不变"),c(NH3)____0.5mol/L (填“>”、“<”或“=”)。
【答案】K =![]() bd 0.0625 L2·mol-2 减小 <
bd 0.0625 L2·mol-2 减小 <
【解析】
(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)可逆反应达到平衡状态时,正、逆反应速率相等(同种物质)或正、逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)先计算各种物质的平衡浓度,带入平衡常数表达式,可得该反应的化学平衡常数的值;
(4)利用压强对化学平衡移动的影响分析平衡移动的方向,判断物质的平衡转化率及物质的平衡浓度大小。
(1)反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数K=
2NH3(g)的化学平衡常数K=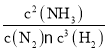 ;
;
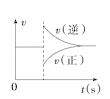
(2)a.NH3生成的速率与NH3分解的速率相等,表明正逆反应速率相等,达到了平衡状态,故a正确;
b.单位时间内消耗a mol N2,同时生成2a mol NH3,表示的都是正反应速率,无法判断正、逆反应速率是否相等,b错误;
c.该反应是反应前后气体体积不等的反应,反应在恒容密闭容器中进行,若压强不再随时间变化而变化,说明气体总物质的量不再改变,反应达到平衡状态,c正确;
d.容器内的密度不再变化,该反应两边都是气体,气体的质量不变,反应中容器的容积不变,根据ρ=![]() 可知,密度在反应过程中始终不变,不能作为判断平衡状态的依据,d错误;
可知,密度在反应过程中始终不变,不能作为判断平衡状态的依据,d错误;
e.容器内H2的体积分数不再变化,说明H2的物质的量不再随时间变化而变化,此时反应达到平衡状态,e正确;
故合理选项是bd;
(3)在2L密闭容器中进行反应N2(g)+3H2(g)![]() 2NH3(g),反应开始时,充入5molN2和7molH2,c(N2)=5mol÷2L=2.5mol/L,c(H2)=7mol÷2L=3.5mol/L,达到平衡时,测得c(N2)=2.0mol/L,则根据物质反应转化关系可知△c(N2)=2.5mol/L-2.0mol/L=0.5mol/L,△c(H2)=1.5mol/L,△c(NH3)=1.0mol/L,因此平衡时各种物质的浓度:c(N2)=2.0mol/L,c(H2)=3.5mol/L-1.5mol/L=2.0mol/L,c(NH3)=1.0mol/L,所以该反应的化学平衡常数K=
2NH3(g),反应开始时,充入5molN2和7molH2,c(N2)=5mol÷2L=2.5mol/L,c(H2)=7mol÷2L=3.5mol/L,达到平衡时,测得c(N2)=2.0mol/L,则根据物质反应转化关系可知△c(N2)=2.5mol/L-2.0mol/L=0.5mol/L,△c(H2)=1.5mol/L,△c(NH3)=1.0mol/L,因此平衡时各种物质的浓度:c(N2)=2.0mol/L,c(H2)=3.5mol/L-1.5mol/L=2.0mol/L,c(NH3)=1.0mol/L,所以该反应的化学平衡常数K=![]() L2·mol-2=0.0625 L2·mol-2;
L2·mol-2=0.0625 L2·mol-2;
(4)在(3)所得平衡状态的基础上,将容器扩大到原来的两倍,c(NH3)瞬间变为原平衡的![]() ,即为0.5mol/L,此时容器内压强减小,由于该反应的正反应为气体体积减小的反应,减小压强,化学平衡向气体体积增大的逆方向移动,则反应N2的转化率减小,达到平衡时c(NH3)<0.5mol/L。
,即为0.5mol/L,此时容器内压强减小,由于该反应的正反应为气体体积减小的反应,减小压强,化学平衡向气体体积增大的逆方向移动,则反应N2的转化率减小,达到平衡时c(NH3)<0.5mol/L。

 阅读快车系列答案
阅读快车系列答案