【题目】Ⅰ、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______。
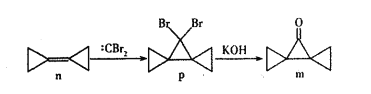
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则滴定结束时的读数为___________ mL,所用硫酸溶液的体积为_______mL。
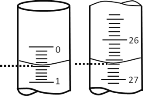
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1硫酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为___mol·L-1(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____(填字母)。
A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸
B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.锥形瓶用水洗涤后,用待测液润洗
(5)酸碱中和滴定原理也可用于其它类型的滴定。如:一种测定水样中Br-的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1 mol/L AgNO3溶液(过量),充分摇匀。
③用c2mol/L KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL。
计算该水样中Br-的物质的量浓度为_______mol·L-1(已知:Ksp(AgBr)= 7.7×10-13,Ag++ SCN-=AgSCN(白色)↓ ,Ksp(AgSCN)= 1×10-12)。
Ⅱ、某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。实验装置如图所示。
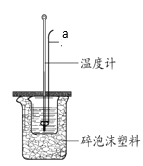
(6)仪器a的名称是_______。
(7)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,和后生成溶液的比热容c=4.18 J/(g·℃)。则计算得中和热ΔH=______(取小数点后一位)。
(8)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
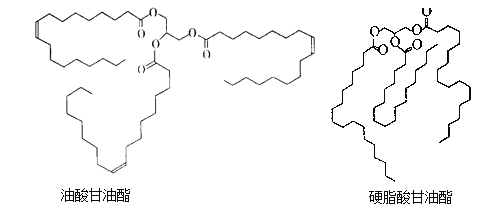
【题目】Ⅰ、某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别加水稀释,其pH随加水体积的变化如图所示。

(1)曲线Ⅰ代表____溶液(填“HNO2”或“CH3COOH”,下同)。
(2)a点时,物质的量浓度较大的是______溶液。相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)较少的是_____。
(3)b、c两点溶液中水的电离程度较大的是___ (填“b”或“c”)。
(4)CH3COOH的稀释过程中,下列说法正确的是___ (填编号)。
a.CH3COOH的电离常数增大
b.H+的物质的量减小
c. ![]() 保持不变
保持不变
d. CH3COOH的电离程度增大,溶液的导电能力增强
Ⅱ、25℃,两种酸的电离平衡常数如表。
|
| |
H2A | 4.4×10-7 | 4.7×10-11 |
H2B | 1.3×10-7 | 7.1×10-15 |
(5)HA-的电离平衡常数表达式K =_______。
(6)0.10 molL-1 NaHB溶液中H+、OH-、Na+、HB-的浓度由大到小的顺序为_______。
(7)等浓度的四种溶液:a. Na2A、b. NaHA、c. Na2B、d. NaHB的pH由大到小顺序是_______(填字母)。