题目内容
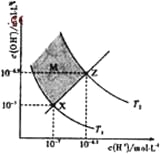
【题目】对反应3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
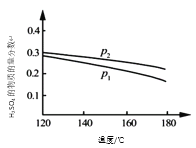
(1)p2___ p1(填“>”或“<”),得出该结论的理由是____。
(2)为了提高SO2的平衡转化率,可采取适当增大压强、_____、______(任意补充两个合理措施)。
【答案】> 相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1 降低温度 充入H2O(g)(其余合理答案也可)
【解析】
(1)从反应方程式看,反应物分子都为气体,而生成物分子都为非气体;从图中可以看出,p2时H2SO4的物质的量分数大,依据平衡移动原理,可确定p2与 p1的大小关系。
(2)由图中信息,可确定温度变化对H2SO4的物质的量分数的影响。为了提高SO2的平衡转化率,可采取适当增大压强、改变温度、加入反应物或取出生成物等。
(1)从反应方程式看3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s),反应物分子都为气体,而生成物分子都为非气体;从图中可以看出,p2时H2SO4的物质的量分数大。依据平衡移动原理,加压,平衡正向移动,产物的物质的量分数大,所以p2>p1;得出该结论的理由是相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1。答案为:>;相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1;
2H2SO4(l) + S(s),反应物分子都为气体,而生成物分子都为非气体;从图中可以看出,p2时H2SO4的物质的量分数大。依据平衡移动原理,加压,平衡正向移动,产物的物质的量分数大,所以p2>p1;得出该结论的理由是相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1。答案为:>;相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1;
(2)从图中可以看出,升高温度,H2SO4的物质的量分数减小,则表明正反应为放热反应。为了提高SO2的平衡转化率,可采取适当增大压强、降温、加入反应物或取出生成物等。答案为:降低温度;充入H2O(g)(其余合理答案也可)。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案