题目内容
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.标况下,11.2L甲醇中含有的电子数9NA
B.6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C.100mL0.1mol/L的KAl(SO4)2溶液中含有的阳离子总数小于0.02NA
D.分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
【答案】B
【解析】
A.标准状况下,甲醇不是气体,不能利用气体摩尔体积计算11.2L甲醇的物质的量,也不能计算出11.2L甲醇中含有的电子数,A错误;
B.甲醛(HCHO)和醋酸的最简式均为CH2O,则6.0g甲醛(HCHO)和醋酸的混合物中含CH2O的物质的量为![]() = 0.2 mol,含有的原子个数为0.2mol×4×NA= 0.8NA,B项正确;
= 0.2 mol,含有的原子个数为0.2mol×4×NA= 0.8NA,B项正确;
C.因为Al3+在溶液中水解,Al3++3H2O![]() Al(OH)3+3H+,会使阳离子数目增加,所以100mL 0.1mol/L的KAl(SO4)2溶液中含有的阳离子总数大于0.02NA,C错误;
Al(OH)3+3H+,会使阳离子数目增加,所以100mL 0.1mol/L的KAl(SO4)2溶液中含有的阳离子总数大于0.02NA,C错误;
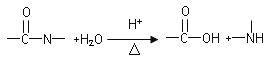
D.2H2O2![]() O2↑+2H2O,双氧水中的氧元素从-1价升高到0价,每生成1mol O2转移2mole-;2 KMnO4
O2↑+2H2O,双氧水中的氧元素从-1价升高到0价,每生成1mol O2转移2mole-;2 KMnO4 ![]() K2MnO4+ MnO2+ O2↑,KMnO4中氧元素从-2价到0价,每生成1mol O2转移4mole-,D错误;
K2MnO4+ MnO2+ O2↑,KMnO4中氧元素从-2价到0价,每生成1mol O2转移4mole-,D错误;
答案选B。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c (Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | x | 8.3 | 8.2 | 9.4 |
常温下,Ksp[Fe(OH)3]=1×10-38,溶液中当离子浓度小于1×10-5mol/L时可认为沉淀完全。回答下列问题:
(1)用稀硫酸溶浸时,产生PbSO4和SiO2沉淀,经过滤后,向滤液中加入O2、ZnO,目的是除去杂质Fe2+、Fe3+,则氧化除杂工序中ZnO的作用是调节溶液的pH,应调节溶液的pH的范围为_______(填数值)。
(2)用铂电极电解硫酸锌溶液制备单质锌时,电解的总反应为________,电解使锌沉积后,电解液可返回_______工序循环使用。
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
化学键 | H-H | C-O | | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1(用数值表示),则△H3=______kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____(填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
【题目】Ⅰ、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______。
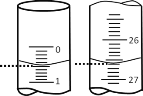
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则滴定结束时的读数为___________ mL,所用硫酸溶液的体积为_______mL。
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1硫酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为___mol·L-1(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____(填字母)。
A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸
B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.锥形瓶用水洗涤后,用待测液润洗
(5)酸碱中和滴定原理也可用于其它类型的滴定。如:一种测定水样中Br-的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1 mol/L AgNO3溶液(过量),充分摇匀。
③用c2mol/L KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL。
计算该水样中Br-的物质的量浓度为_______mol·L-1(已知:Ksp(AgBr)= 7.7×10-13,Ag++ SCN-=AgSCN(白色)↓ ,Ksp(AgSCN)= 1×10-12)。
Ⅱ、某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。实验装置如图所示。

(6)仪器a的名称是_______。
(7)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,和后生成溶液的比热容c=4.18 J/(g·℃)。则计算得中和热ΔH=______(取小数点后一位)。
(8)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 |
|
|
水的离子积常数 |
| a |
|
试回答以下问题:
(1)若![]() ,则α________(填“<”、“>”或“=”)
,则α________(填“<”、“>”或“=”)![]() ,作出此判断的理由是________________。
,作出此判断的理由是________________。
(2)![]() 下,某
下,某![]() 溶液中
溶液中![]() ,取该溶液
,取该溶液![]() ,加水稀释至
,加水稀释至![]() ,则稀释后溶液中
,则稀释后溶液中![]() ________。
________。
(3)![]() 下,将
下,将![]() 的苛性钠溶液
的苛性钠溶液![]() 与
与![]() 的稀硫酸
的稀硫酸![]() 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的![]() ,则
,则![]() ________。此溶液中各种离子的浓度由大到小的排列顺序是___________。
________。此溶液中各种离子的浓度由大到小的排列顺序是___________。