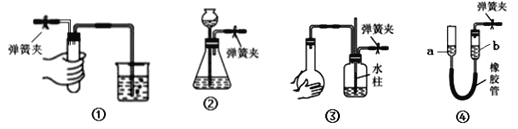
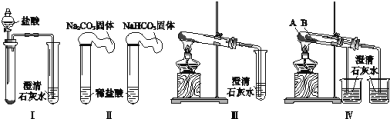
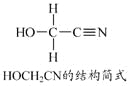
题目内容
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
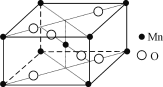
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
【答案】[Ar]3d5 平面正三角形 sp2 1∶1 N>C>H Mn(NO3)2![]() MnO2+2NO2↑
MnO2+2NO2↑
【解析】
(1)Mn原子核外电子数为25,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
根据价层电子对互斥理论判断NO3-的空间构型;
(2)甲醛分子中C原子价层电子对个数为3且不含孤电子对;
(3)HCN的分子结构为H-C![]() N,根据结构式推出σ键与π键的数目比;同周期元素从左到右元素的电负性逐渐增大,据此分析;
N,根据结构式推出σ键与π键的数目比;同周期元素从左到右元素的电负性逐渐增大,据此分析;
(4)根据该氧化物晶胞结构,结合均摊法算出氧化物的化学式,再写出化学方程式。
(1)Mn为25号元素,Mn2+基态核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;
NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形;
(2)甲醛分子中C原子价层电子对个数为3且不含孤电子对,所以甲醛为平面三角形结构,C原子杂化类型是sp2;
(3) HCN的分子结构为H-C![]() N,其中C-H键为σ键,C
N,其中C-H键为σ键,C![]() N键中含1个σ键和2个π键,故σ键与π键的数目比为1:1;
N键中含1个σ键和2个π键,故σ键与π键的数目比为1:1;
同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N,H的电负性最小,故有:N>C>H;
(4) 根据该氧化物晶胞结构,结合均摊法可知,锰原子数为![]() ,O原子数为
,O原子数为![]() ,则氧化物的化学式为MnO2,硝酸锰受热可分解生成NO2和MnO2,则硝酸锰受热分解的化学方程式为:Mn(NO3)2
,则氧化物的化学式为MnO2,硝酸锰受热可分解生成NO2和MnO2,则硝酸锰受热分解的化学方程式为:Mn(NO3)2![]() MnO2+2NO2↑。
MnO2+2NO2↑。