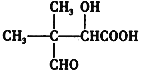
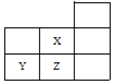
【题目】如图是元素周期表的一部分:
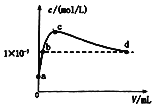
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
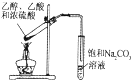
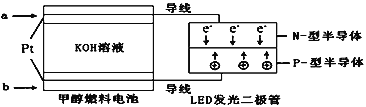
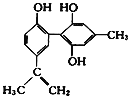
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________