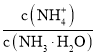【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~4min的平均反应速率:v(H2O2)>3.3×10-2mol·L-1·min-1
C.反应至6 min时,H2O2分解了50%
D.反应至6 min时,c(H2O2)=0.25 mol/L
【题目】从下列事实所得出的解释或结论正确的是
选项 | 实验事实 | 解释或结论 |
A | 已知 | 金刚石比石墨稳定 |
B |
| 这是一个熵增反应 |
C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
A.AB.BC.CD.D