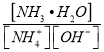题目内容
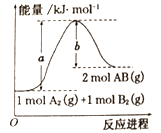
【题目】雾霾天气的“罪魁祸首”是空气中的CO、NO、NO2等污染气体在大气中反应产生PM2.5 颗粒物,研究NO、NO2、CO 等污染物的处理,对环境保护有重要的意义。
(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为_____。
(2) 由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
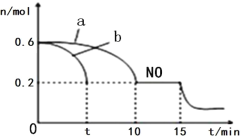
①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”) 。
②T℃时,该反应的化学平衡常数K=____;(保留小数点后一位小数)平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_____移动。(填“向左”、“向右”或“不”)
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_________(任答一条即可)。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是_________用离子方程式表示)。向该溶液滴加c L 氨水后溶液呈中性,则所滴加氨水的浓度为_____molL﹣1。(NH3H2O 的电离平衡常数K =2×10﹣5 molL﹣1)
【答案】2NO2(g)+4CO(g) = 4CO2(g)+N2(g) △H=-852.3KJ/mol 3.1×105 b 40 L/mol 向右 增加 CO 的物质的量浓度减少生成物浓度或降温 NH4 + + H2 O![]() NH3·H2O+ H+
NH3·H2O+ H+ ![]()
【解析】
(1)根据盖斯定律写出热化学方程式;
(2)当v正= v逆时,反应达到平衡状态,K逆·c(CO2) ·c(O)= K正·c(CO) ·c(O2),则![]() =
= ![]() =K;
=K;
(3)①催化剂的表面积越大,催化效果越好,反应速率越大,反应时间越短;
②用三段式计算K,用Q和K的大小判断平衡移动方向
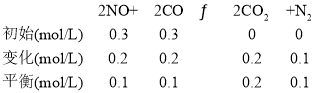
K=![]() =
=![]() =40;再向容器中充入CO、CO2各0.2 mol,Q=
=40;再向容器中充入CO、CO2各0.2 mol,Q=![]() =22.5,则平衡正向移动;
=22.5,则平衡正向移动;
③15min 时,若改变外界反应条件,导致n (NO)减小,反应正向进行,且改变条件瞬时n (NO)未变;
(4)NH4NO3为强酸弱碱盐,溶液中的铵根离子水解显酸性;向该溶液滴加c L 氨水后溶液呈中性,则c(H+)= c(OH-),根据溶液呈电中性,求出c(NH4+),根据K = 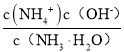 ,计算原氨水的浓度;
,计算原氨水的浓度;
(1)若NO2气体和CO 气体反应生成无污染气体,反应式:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g),①NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1,②N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1,③2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1,则4①-2②+③即可,△H=-230.0![]() -(-180.0)+(-112.3)=-852.3kJ/mol;答案为:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g) △H=-852.3kJ/mol;
-(-180.0)+(-112.3)=-852.3kJ/mol;答案为:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g) △H=-852.3kJ/mol;
(2)当v正= v逆时,反应达到平衡状态,K逆·c(CO2) ·c(O)= K正·c(CO) ·c(O2),则![]() =
= ![]() =K,K逆=
=K,K逆=![]() = 3.1×105;
= 3.1×105;
(3)①催化剂的表面积越大,催化效果越好,反应速率越大,反应时间越短,则答案为b;
②T℃时,
K=![]() =
=![]() =40;
=40;
再向容器中充入CO、CO2各0.2 mol,Q=![]() =22.5,则平衡正向移动;
=22.5,则平衡正向移动;
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,反应正向进行,且改变条件瞬时n (NO)未变,则增加 CO 的物质的量浓度减少生成物浓度或降温;
(4)NH4NO3为强酸弱碱盐,溶液中的铵根离子水解显酸性,离子反应为:NH4+ + H2 O=NH3·H2O+ H+;向该溶液滴加c L 氨水后溶液呈中性,则c(H+)= c(OH-),根据溶液呈电中性,c(NH4+)+c(H+)= c(OH-)+c(NO3-),可知c(NH4+)= c(NO3-),K = 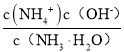 ,设混和溶液的体积为V,则c(NH4+)= c(NO3-)=
,设混和溶液的体积为V,则c(NH4+)= c(NO3-)=![]() ,此时溶液呈中性,c(OH-)=10-7mol/L,原氨水的浓度=
,此时溶液呈中性,c(OH-)=10-7mol/L,原氨水的浓度=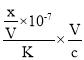 =
=![]() ;
;