【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+![]() O2(g)═H2O(g) △H=﹣242kJmol﹣1
O2(g)═H2O(g) △H=﹣242kJmol﹣1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
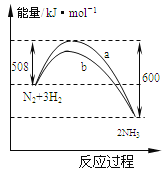
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a.  b.
b. 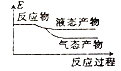 c.
c. 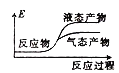 d.
d. 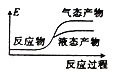
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣90.1kJmol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(molL﹣1)变化如下表所示(前6min没有改变条件)
2min | 4min | 6min | 8min | ||
CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
H2 | x | 0.12 | 0.12 | 0.2 | …… |
CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000molL﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
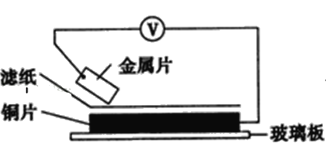
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极